
【题目】常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
【答案】C
【解析】
A项,盐酸是强酸,在水溶液里完全电离,醋酸是弱酸,在水溶液里不完全电离,则常温下,浓度均为0.1mol·L-1的盐酸和醋酸,pH:盐酸小于醋酸,故A错误;
B项,盐酸和醋酸均为一元酸,浓度相同、体积相同,则两种酸的物质的量相同,和相同浓度的NaOH溶液反应,消耗的NaOH溶液体积相同,故B错误;
C项,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又因为已知溶液呈碱性,所以c(H+)<c(OH-),则![]() 1,故C正确;
1,故C正确;
D项,盐酸电离程度大于醋酸电离程度,所以盐酸对水的电离抑制程度大,两种溶液中水电离出的氢离子:盐酸小于醋酸,故D错误。
综上所述,符合题意的选项为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 常温时,在c(H+)=![]() 的溶液:Na+、Al3+、Cl-、S2-
的溶液:Na+、Al3+、Cl-、S2-
B. 由水电离的c(H+)=10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(OH-)/c(H+)=10-12的溶液中:NH4+、Al3+、NO3-、Cl-
D. 加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有______,看到的现象是_______,反应的化学方程式为__________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是________,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
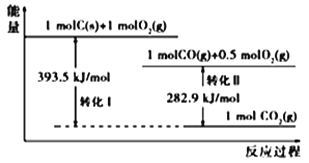
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. ![]()
(2)CH3COONH4的水溶液呈_______(选填酸性”、“中性"或“碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H=akJ/mol
CH3CH2OH(g)+3H2O(g) △H=akJ/mol
在一定压强下,测得.上述反应的实验数据如下表。

根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即![]() ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________________________。
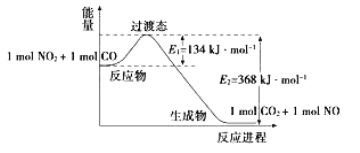
(2)总反应:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O写出下列的电极反应式
负极:_____________________________
正极:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
A. 该反应的平衡常数不变 B. 平衡向正反应方向移动
C. SO3的浓度增大 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
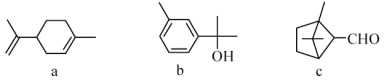
A. a和b都属于芳香族化合物
B. b的一氯代物有5种
C. a、b和c均能和氢气在一定条件下发生加成反应
D. a和c分子中所有碳原子均处于同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com