
【题目】根据如下能量关系示意图,下列说法正确的是
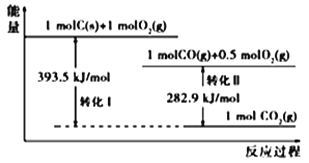
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= 221.2 kJmol1
D. CO的燃烧热ΔH=+282.9 kJmol1
【答案】C
【解析】
A、由图可知,1 mol C(s)与1 mol O2(g)的能量之和大于393.5 kJ,而1 mol C(g)与1 mol O2(g)的能量之和远大于393.5 kJ,选项A错误;B、由图可知,1 mol CO(g)与0.5mol O2(g)生成1 mol CO2(g)放出282.9 kJ的热量,所以反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量小于反应物的总能量,选项B错误;C、由图可知,1 mol C(s)与0.5mol O2(g)转化为1 mol CO(g),放出热量为:393.5-282.9=110.6 kJ,所以2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1,选项C正确;D、根据选项B得反应CO(g)+![]() O2(g) =CO2(g) ΔH= 282.9 kJmol1,可知CO的燃烧热ΔH=-282.9 kJmol1,选项D错误。答案选C。
O2(g) =CO2(g) ΔH= 282.9 kJmol1,可知CO的燃烧热ΔH=-282.9 kJmol1,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)![]() B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8m01·L一1需要20s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为
B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8m01·L一1需要20s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为
A. l0sB. 大于10sC. 小于10sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X____________________ Y___________________
Z____________________ W___________________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是
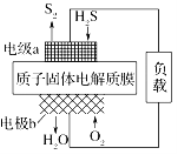
A. 电极a为电池的负极
B. 电极b上发生的电极反应为O2+4H++4e-===2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 L H2S
D. 每0.5molH2S参与反应,有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 加入CH3OH的物质的量a=1.64
B. 此时刻正反应速率大于逆反应速率
C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com