
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
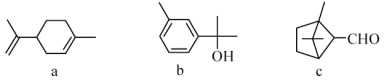
A. a和b都属于芳香族化合物
B. b的一氯代物有5种
C. a、b和c均能和氢气在一定条件下发生加成反应
D. a和c分子中所有碳原子均处于同一平面上
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O (g)![]() CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 平衡时,乙中的c(CO)是甲中的2倍
D. 平衡时,乙中H2O的转化率是50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 加入CH3OH的物质的量a=1.64
B. 此时刻正反应速率大于逆反应速率
C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx、CO、SO2等大气污染气体的处理和利用是世界各国研究的热点问题。
(1)已知:
I. 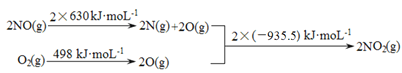
II. 2NO(g)+O2(g) ![]() 2NO2(g) ΔH1
2NO2(g) ΔH1
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH2 =-196.6 kJ·mol-1
2SO3(g) ΔH2 =-196.6 kJ·mol-1
① ΔH1 =________________kJ·mol-1。
② 写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式________。
(2)煤炭燃烧过程中释放出大量的SO2,严重破坏生态环境。燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,该反应的化学方程式是______。
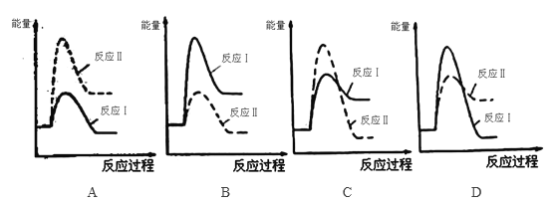
(3)煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
资料:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率
请回答下列问题:
① 下列反应过程能量变化示意图正确的是_______________。
② 图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有_________(填字母)。
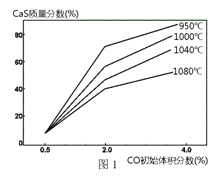
A. 向该反应体系中投入石灰石
B. 在合适的温度区间内控制较低的反应温度
C. 提高CO的初始体积百分数
D. 提高反应体系的温度
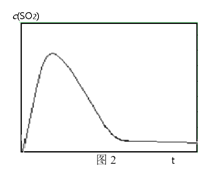
③ 图2表示恒温恒容条件下反应体系中c(SO2)随时间t变化的总趋势图。请从化学反应原理的角度解释c(SO2)先增加后降低的原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨—液氧燃料电池曾用于驱动潜艇,其示意图如图所示。
(1)该电池的总反应式为_____________,电极1发生的电极反应为__________;
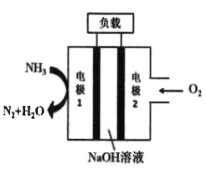
(2)下列说法正确的是______________;
A. 电极2是正极,发生还原反应
B. 电池工作时,Na+向电极1移动
C. 电流由电极2经外电路流向电极1
D. 该装置将化学能转化为电能再转化为机械能
(3)当电路中通过的电子数为0.4mol时,理论上需消耗标准状况下氧气的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com