
����Ŀ��NOx��CO��SO2�ȴ�����Ⱦ����Ĵ�������������������о����ȵ����⡣
��1����֪��
I. 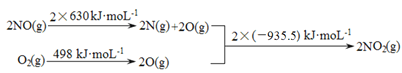
II. 2NO��g����O2��g�� ![]() 2NO2��g�� ��H1
2NO2��g�� ��H1
2SO2��g����O2��g�� ![]() 2SO3��g�� ��H2 =��196.6 kJ��mol-1
2SO3��g�� ��H2 =��196.6 kJ��mol-1
�� ��H1 =________________kJ��mol-1��
�� д��NO2������SO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽ________��
��2��ú̿ȼ�չ������ͷų�������SO2�������ƻ���̬������ȼ�չ����м���ʯ��ʯ������Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷţ��÷�Ӧ�Ļ�ѧ����ʽ��______��
��3��ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ������������Ч�ʡ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Ӧ��CaSO4��s����CO��g��![]() CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
��Ӧ��CaSO4��s����4CO��g��![]() CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
���ϣ��ٷ�Ӧ���ͷ�Ӧ��ͬʱ���� �ڷ�Ӧ�������ʴ��ڷ�Ӧ��������
��ش��������⣺
�� ���з�Ӧ���������仯ʾ��ͼ��ȷ����_______________��
�� ͼ1Ϊʵ���ò�ͬ�¶��·�Ӧ��ϵ��CO��ʼ����ٷ�����ƽ��ʱ���������CaS�����ٷ����Ĺ�ϵ���ߡ��÷�Ӧ��ϵ��SO2�������Ĵ�ʩ��_________������ĸ����
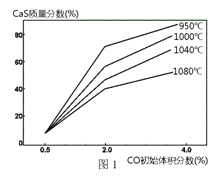
A. ��÷�Ӧ��ϵ��Ͷ��ʯ��ʯ
B. �ں��ʵ��¶������ڿ��ƽϵ͵ķ�Ӧ�¶�
C. ���CO�ij�ʼ����ٷ���
D. ��߷�Ӧ��ϵ���¶�
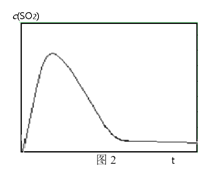
�� ͼ2��ʾ���º��������·�Ӧ��ϵ��c��SO2����ʱ��t�仯��������ͼ����ӻ�ѧ��Ӧԭ���ĽǶȽ���c��SO2�������Ӻ͵�ԭ��_______��
���𰸡� ��113 NO2��g����SO2��g��![]() SO3��g����NO��g�� ��H=��41.8 kJ��mol-1 2CaCO3��2SO2��O2=2CaSO4��2CO2 C A B C ��Ϊ
SO3��g����NO��g�� ��H=��41.8 kJ��mol-1 2CaCO3��2SO2��O2=2CaSO4��2CO2 C A B C ��Ϊ![]() ��
��![]() ����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С
����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С
����������1���ٷ�Ӧ��=��Ӧ��ϼ�����������ȥ������ɼ��ų��������ݴ˽��м��㡣
�ڸ��ݸ�˹���ɽ��м��㡣
��2����������ܹ�����������Ϊ����ơ�
��3������ͼ���֪����Ӧ�����ȣ���Ӧ�����ȡ���Ӧ���з�Ӧ������������������������������Ӧ���з�Ӧ������������������������������Ӧ�������ʣ�![]() �����ڷ�Ӧ�������ʣ�
�����ڷ�Ӧ�������ʣ�![]() ����˵����Ӧ���Ļ�ܵ��ڷ�Ӧ���Ļ�����ݴ˷�����
����˵����Ӧ���Ļ�ܵ��ڷ�Ӧ���Ļ�����ݴ˷�����
�ڽ��Ͷ������������������Ӧ������С�
�۷�Ӧ���Ͽ죬�����ɴ�����SO2�����ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С��
��1���ٷ�Ӧ��=��Ӧ��ϼ�����������ȥ������ɼ��ų���������H1=2��630+498-2��935.5=��113 kJ��mol-1 ����ȷ������113��
����֪��Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H��196.6 kJ��mol�C1����2NO(g)+O2(g)
2SO3(g) ��H��196.6 kJ��mol�C1����2NO(g)+O2(g)![]() 2NO2(g) ��H��113.0 kJ��mol�C1������ݸ�˹���ɿ�֪���٣�������2���õ���ӦNO2(g)��SO2(g)
2NO2(g) ��H��113.0 kJ��mol�C1������ݸ�˹���ɿ�֪���٣�������2���õ���ӦNO2(g)��SO2(g)![]() SO3(g)��NO(g)�����Ը÷�Ӧ�ķ�Ӧ����H��(196.6 kJ/mol��113.0 kJ/mol)��2����41.8kJ/mol����ȷ����NO2��g����SO2��g��
SO3(g)��NO(g)�����Ը÷�Ӧ�ķ�Ӧ����H��(196.6 kJ/mol��113.0 kJ/mol)��2����41.8kJ/mol����ȷ����NO2��g����SO2��g��![]() SO3��g����NO��g�� ��H=��41.8 kJ��mol-1 ��
SO3��g����NO��g�� ��H=��41.8 kJ��mol-1 ��
��2��̼������������Ӧ������������ƺͶ�����̼��������Ʊ���������Ϊ����ƣ��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�2CaCO3��2SO2��O2=2CaSO4��2CO2 ����ȷ����2CaCO3��2SO2��O2=2CaSO4��2CO2 ��
��3�������Ȼ�ѧ����ʽ��֪����Ӧ�����ȣ���Ӧ�����ȡ���Ӧ���з�Ӧ������������������������������Ӧ���з�Ӧ�������������������������������A��D���������֪��Ӧ�������ʣ�![]() �����ڷ�Ӧ�������ʣ�
�����ڷ�Ӧ�������ʣ�![]() ����˵����Ӧ���Ļ�ܵ��ڷ�Ӧ���Ļ�ܣ���B����C��ȷ����ȷѡ��C��
����˵����Ӧ���Ļ�ܵ��ڷ�Ӧ���Ļ�ܣ���B����C��ȷ����ȷѡ��C��
��ʯ��ʯ�ڸ����»�ֽ����ɶ�����̼��̼���ƣ����ڶ�����̼�����ɣ�ʹ��ӦIƽ�����ƣ��Ӷ����Ͷ���������������Ҳ��������Ϊ���Ͷ�����������������������������������ͼ�����ɵã��ɲ�ȡ�Ĵ�ʩ���ں��ʵ��¶������ڿ��ƽϵ͵ķ�Ӧ�¶��Լ����һ����̼�ٷ�����A B C����ȷ����ȷѡ��A B C��
�۴�ͼ��ɳ�c��SO2�������Ӻͣ�ԭ���ǣ���Ϊ![]() ��
��![]() ����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С����ȷ�𰸣���Ϊ
����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С����ȷ�𰸣���Ϊ![]() ��
��![]() ����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С��
����Ӧ���Ͽ죬�����ɴ�����SO2������SO2Ũ�����������ŷ�Ӧʱ�����������Ϊ��Ӧ�����ȴ�ƽ����������еij̶ȴ�����CO��ʹ��Ӧ����COŨ�Ƚ��ͣ���Ӧ��ƽ�������ƶ���SO2Ũ�ȼ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�±��������£���������ĵ���ƽ�ⳣ��(Ka)������ĵ���ƽ�ⳣ��(Kb):

��ش���������:
(1)������ˮϡ��0.1mol/L�Ĵ�����Һ,����ѡ����һ����С����_____
A.c(H+) B.c(H+)��c(OH-) C. ![]()
(2)CH3COONH4��ˮ��Һ��_______(ѡ�����ԡ���������"���ԡ�)��
(3)Ũ��Ϊ0.10mol/L�����������(Na2HC6H5O7)��Һ������,ͨ������˵����ԭ��______��
(4)��ҵ�г���̼�����Ʊ�����������֪:Ksp(NiCO3)=1.4��10-7����Ni,2+ǡ����ȫת��ΪNiCO3����[����Һ��c(Ni2+)=1��10-5mol��L-1]ʱ,��Һ��c(CO32-)=_____mol/L��
II.(1)�Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ��H=akJ/mol
CH3CH2OH(g)+3H2O(g) ��H=akJ/mol
��һ��ѹǿ��,���.������Ӧ��ʵ���������±���

���ݱ������ݷ���:
��������Ӧ��a_____0(��"���ڡ���С�ڡ�)��
����һ���¶���.�����̼[��![]() ]��,ƽ�ⳣ��Kֵ_____(���������С������"���䡱)��
]��,ƽ�ⳣ��Kֵ_____(���������С������"���䡱)��
(2)�������ڵ�������,�ڹ̶��ݻ����ܱ�������Ͷ��һ������CO��H2,ͬ�����Ƶ��Ҵ�(���淴Ӧ)���÷�Ӧ�����������仯��ͼ��ʾ;

������ͼ,д����Ӧ���Ȼ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ף�P4S3���ǻ���ɫ��״���壬��ȼ���ж������ӽṹ֮һ��ͼ��ʾ����֪��ȼ��ʱP������ΪP4010�������й�P4S3��˵���в���ȷ����

A. P4S3����Ԫ��Ϊ+3��
B. P4S3���ڹ��ۻ�����
C. P4S3���ȼ�յĻ�ѧ����ʽΪP4S3+8O2=P4O10+3SO2
D. 1mol P4S3�����к���9mol���ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴ӦΪ��SiHCl3��g����H2��g��![]() Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
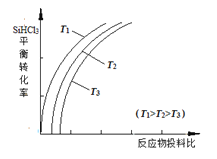
A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. �������ʾ��Ͷ�ϱ�Ӧ����![]()
C. �÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D. ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺�����ڶ�ֲ�����ڣ�����������������˵����ȷ����
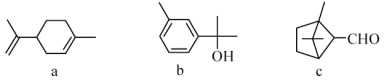
A. a��b�����ڷ����廯����
B. b��һ�ȴ�����5��
C. a��b��c���ܺ�������һ�������·����ӳɷ�Ӧ
D. a��c����������̼ԭ�Ӿ�����ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ��������,������ȷ����( )
A.������������һ�ֻ���ɫ���ж�������,����Ư����
B.���ø����ʯ����ֽ��֤��ˮ�Ƿ����
C.������������Ӧ,Һ�Ȳ��������ڸ�ƿ��
D.��������ˮ��Һ����ͬһ������,ֻ��״̬��ͬ,�����ڴ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ��������SO2��CO2���ѡ�õĻ�ѧ�Լ��ǣ�
A. ��ɫ��ʯ����Һ B. Ʒ����Һ
C. �����ʯ��ˮ D. ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ�þ���ȷ���ǣ� ��

A. �ü�װ�ô���������ȡ������ű������Ч��������
B. ����װ����������к͵ζ��ı�Һ��0.1000mol/L HCl��
C. �ñ�װ�ôӺ���������ȡ�ⵥ��
D. �ö�װ�ý��������ʵ�����K2SO4��Al2(SO4)3�Ļ����Һ���ɵõ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������ͨ��30 mLŨ��Ϊ10.00 mol��L��1����������Ũ��Һ������������ʱ�����Һ���γ�NaCl��NaClO��NaClO3������ϵ�������ж���ȷ����
A. ��NaOH��Ӧ������һ��Ϊ0.3 mol
B. n(Na��)��n(Cl��)����Ϊ7��3
C. ����Ӧ��ת�Ƶĵ���Ϊn mol����0.15��n��0.25
D. n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ11��2��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com