
【题目】下列实验操作与装置均正确的是( )

A. 用甲装置从青蒿中提取对治疗疟疾有特效的青蒿素
B. 用乙装置配制酸碱中和滴定的标准液(0.1000mol/L HCl)
C. 用丙装置从海带灰中提取碘单质
D. 用丁装置将含等物质的量的K2SO4和Al2(SO4)3的混合溶液蒸干得到明矾晶体
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,己知气体A在标准状况下相对氢气的密度为13,B可发生银镜反应,它们之间的转化关系如右图。请回答:

(1)有机物C中含有的官能团名称是________,反应③的反应类型是____________。
(2)反应①的原子利用率达100%,该反应的化学方程式是______________________。
(3)下列说法正确的是__________________。
A.反应④也能实现原子利用率100%
B.乙酸乙酯在氢氧化钠溶液中水解的反应叫作皂化反应
C.有机物A、B、C均能使酸性高锰酸钾溶液褪色
D.有机物B和D都可以与新制碱性氢氧化铜悬浊液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx、CO、SO2等大气污染气体的处理和利用是世界各国研究的热点问题。
(1)已知:
I. 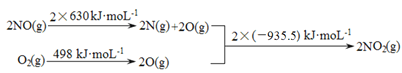
II. 2NO(g)+O2(g) ![]() 2NO2(g) ΔH1
2NO2(g) ΔH1
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH2 =-196.6 kJ·mol-1
2SO3(g) ΔH2 =-196.6 kJ·mol-1
① ΔH1 =________________kJ·mol-1。
② 写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式________。
(2)煤炭燃烧过程中释放出大量的SO2,严重破坏生态环境。燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,该反应的化学方程式是______。
(3)煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
资料:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率
请回答下列问题:
① 下列反应过程能量变化示意图正确的是_______________。
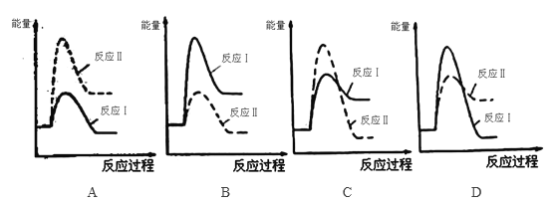
② 图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有_________(填字母)。
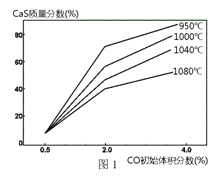
A. 向该反应体系中投入石灰石
B. 在合适的温度区间内控制较低的反应温度
C. 提高CO的初始体积百分数
D. 提高反应体系的温度
③ 图2表示恒温恒容条件下反应体系中c(SO2)随时间t变化的总趋势图。请从化学反应原理的角度解释c(SO2)先增加后降低的原因_______。
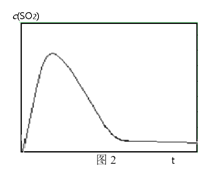
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中:2NO2 ![]() 2NO+O2。不能说明反应达平衡状态的是:
2NO+O2。不能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2; ②单位时间内生成n mol O2 的同时,生成2n mol NO; ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态; ④混合气体的颜色不再改变的状态; ⑤混合气体的密度不再改变的状态; ⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
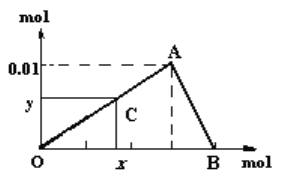
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是:______________________________;由此可得A点的坐标为_______;此时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________________,由此可得B点的坐标为:_________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的硝化反应,下列说法不正确的是( )
A. 浓硫酸起了催化剂、吸水剂的作用
B. 加热50-60℃通常通过水浴来实现
C. 由于苯和硝酸都易挥发,所以通常需要加冷凝装置
D. 纯净得硝基苯为淡黄色比水重的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是

A. 该硫酸的物质的量浓度为 9.2 mol/L
B. 1 mol Zn与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
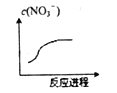
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com