
【题目】关于苯的硝化反应,下列说法不正确的是( )
A. 浓硫酸起了催化剂、吸水剂的作用
B. 加热50-60℃通常通过水浴来实现
C. 由于苯和硝酸都易挥发,所以通常需要加冷凝装置
D. 纯净得硝基苯为淡黄色比水重的液体
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与装置均正确的是( )

A. 用甲装置从青蒿中提取对治疗疟疾有特效的青蒿素
B. 用乙装置配制酸碱中和滴定的标准液(0.1000mol/L HCl)
C. 用丙装置从海带灰中提取碘单质
D. 用丁装置将含等物质的量的K2SO4和Al2(SO4)3的混合溶液蒸干得到明矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗(Ge)、锡(Sn)、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡以前曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其它元素在化合物中都是以高价形式存在比较稳定,回答下列问题:
I.(1)高岭土的成分中含Al2(Si2O5)(OH)4,请改写成氧化物的形式_________________.
(2)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是(用文字叙述)_______________________________
(3)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式_____________________ .二氧化铅在空气中强热会得到一系列铅的其它氧化物。若把239g二氧化铅强热,当质量变为231g时,写出反应的化学方程式____________________________.
II.CH4–CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4–CO2催化重整反应为:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)= CH4 (g) ΔH=–75 kJ·mol1 ①
C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1 ②
2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1 ③
(1)有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)若该反应在容积不变的绝热容器中进行,能够判断该反应已达到平衡的是____(填标号)。
A.c(CO2)/c(H2)不再发生变化
B.气体的密度不再发生变化
C.气体的平均摩尔质量不再发生变化
D.每有8molC-H键生成的同时有4molH-H键的断裂 E.容器的温度不再发生变化
(3)T℃时,在体积为10 L的容器中加入10 mol CH4、5 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,此温度下,该反应的化学平衡常数K=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③
B. 0.2mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(OH-)>c(H+)
C. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去),请回答下列问题:
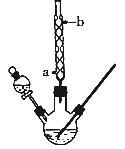
(1)球形冷凝管的作用是____________,冷凝水从____________(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
溶点/℃ | 117.3 | 16.6 | -83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于____________反应(填字母)。
a.加成反应 b.取代反应 c.酯化反应 d.消去反应
②考虑到反应速率等多种因素.用上述装置制备乙酸乙酯时,反应的最佳温度范围是____________(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)反应结束后,欲从反应混合物中分离出乙酸乙酯,应使用的分离方法是____________(填操作方法名称,下同),所用到的主要仪器为____________,进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法:在乙酸乙酯的同类物质的同分异构体中,有一种直链的酯在强碱条件下与新制氢氧化铜浊液混合加热一段时间后,发现生成了砖红色沉淀,请写出的化学方程式________________________。
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g.则乙酸乙酯的产率是____________。
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量.
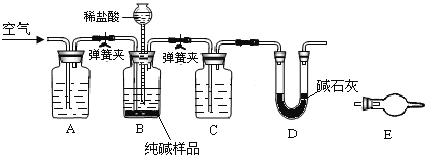
(1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com