
����Ŀ���ں��º��������У�2NO2 ![]() 2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2�� �ڵ�λʱ��������n mol O2 ��ͬʱ������2n mol NO�� ��NO2��NO��O2 �ķ�Ӧ���ʵı�Ϊ2 : 2 : 1��״̬�� �ܻ���������ɫ���ٸı��״̬�� �ݻ��������ܶȲ��ٸı��״̬�� ��������ƽ����Է����������ٸı��״̬��
A. �٢ܢ�B. �ڢۢ�C. �٢ۢ�D. �٢ڢۢܢݢ�
���𰸡�B
��������
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2��ʾ���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����ȷ���ڸ��ݷ���ʽ������n mol O2 ��ͬʱһ������2n mol NO������˵����Ӧ�ﵽƽ��״̬�����۸��ݷ���ʽ����Ϊͬһ�������κ�ʱ��NO2��NO��O2 �ķ�Ӧ���ʵıȶ�����2 : 2 : 1������˵����Ӧ�ﵽƽ��״̬�����ܷ�Ӧ��ֻ�ж�����������ɫ������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬����ȷ����������������䣬������������䣬���������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬������Ӧǰ����������ʵ��������仯��������������䣬��������ƽ����Է����������ŷ�Ӧ�Ľ��з����仯������������ƽ����Է����������䣬��Ӧ�ﵽƽ��״̬����ȷ����Ӧ��ƽ��״̬���Т٢ܢޣ�����˵����Ӧ��ƽ��״̬���Тڢۢݣ���ѡB��


 ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴ӦΪ��SiHCl3��g����H2��g��![]() Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
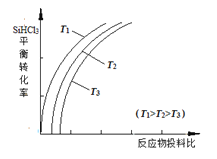
A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. �������ʾ��Ͷ�ϱ�Ӧ����![]()
C. �÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D. ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ��������,������ȷ����( )
A.������������һ�ֻ���ɫ���ж�������,����Ư����
B.���ø����ʯ����ֽ��֤��ˮ�Ƿ����
C.������������Ӧ,Һ�Ȳ��������ڸ�ƿ��
D.��������ˮ��Һ����ͬһ������,ֻ��״̬��ͬ,�����ڴ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ��������SO2��CO2���ѡ�õĻ�ѧ�Լ��ǣ�
A. ��ɫ��ʯ����Һ B. Ʒ����Һ
C. �����ʯ��ˮ D. ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ��������ɫ���������Ʊ�������صĹ����������£�
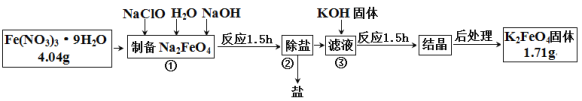
�ش��������⣺
��1���������NaClO��______���������������ԭ��������������
��2��������ѳ����γ�NaNO3 �⣬���� ____________���ѧʽ����
��3��������������ܽ�ȵIJ�ͬ���еIJ��������ܽ�ȣ�Na2FeO4 _____���>����<����K2FeO4��
��4������ʵ����K2FeO4�IJ���Ϊ__________________��
��5��ȡ����K2FeO4���Թ��У��������ữ����ס�Թܿڣ��۲쵽��Һ����ϸ��С���ݲ�������Һ��ɫ����ȥ������һ�������ǵ�ľ����ľ����ȼ��������Һ�м���KSCN��Һ����Һ��ΪѪ��ɫ���������²�������2.24L,��μӷ�Ӧ��FeO42- ��Ŀ_____________��K2FeO4��Ϊ��ˮ�����ŵ��������������ɱ�����__________________________________��
��6��ijͬѧ�����������ʵ��̽��������ص��ȶ��ԡ�
��ʵ��1��������K2FeO4����ֱ��ܽ���pHΪ4.74��7.00��11.50��ˮ��Һ�У����FeO42-Ũ��Ϊ1.0mmolL-1��1mmolL-1=10-3molL-1�������������ã������ͼ1��
��ʵ��2��������K2FeO4�ܽ���pH=4.74��ˮ��Һ�У����Ƴ�FeO42-Ũ��Ϊ1.0mmolL-1���������������ֱ����� 20�桢30�桢40���60��ĺ���ˮԡ�У������ͼ2��
��ʵ����ۣ�����ͼһ�����Եó��Ľ����ǣ�________________________________________
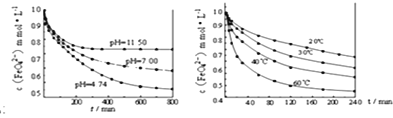
ͼ1 ͼ2
��7�������£�ijˮ��Һ����Fe3+,Cu2+,������ҺpH=10ʱ��������������������棬��֪���¶��£� Ksp��Fe(OH)3��= a, Ksp��Cu(OH)2��= b,����Һ��C(Fe3+)/C(Cu2+)=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ�þ���ȷ���ǣ� ��

A. �ü�װ�ô���������ȡ������ű������Ч��������
B. ����װ����������к͵ζ��ı�Һ��0.1000mol/L HCl��
C. �ñ�װ�ôӺ���������ȡ�ⵥ��
D. �ö�װ�ý��������ʵ�����K2SO4��Al2(SO4)3�Ļ����Һ���ɵõ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ��ȷ������ ��
A. pH��ȵ���NH4Cl��(NH4)2SO4��NH4HSO4��Һ��c(NH4+)��С˳��Ϊ��=�ڣ���
B. 0.2mol��L-1HCl��0.1 mol��L-1NaAlO2��Һ����������c(Cl-)��c(Na+)��c(Al3+)��c(OH-)��c(H+)
C. 0.2 mol��L-1��Na2CO3��Һ��c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D. pH��ȵ�NaF��CH3COOK��Һ��[c(Na+)-c(F-)]��[c(K+)-c(CH3COO-)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.80 g������þ��þ����ȫ����50.0 mL������Һ�μ�2.00 mol��L��1����������Һ��ǡ����ȫ����ʱ��ȥ200.0 mL�������õij������ա���ȴ������ù�������Ϊ4.40 g��
(1)��������������ʵ���Ũ��c(H2SO4)��____________________________��
(2)þ��������þ��þ�����ʵ���֮��Ϊn(MgO)�Un(Mg)��______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com