
����Ŀ�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ衣�䷴ӦΪ��SiHCl3��g����H2��g��![]() Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
Si��s����3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
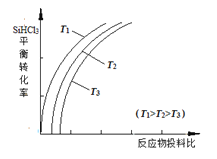
A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. �������ʾ��Ͷ�ϱ�Ӧ����![]()
C. �÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D. ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ
���𰸡�C
��������A.��ͼ����֪��,Ͷ�ϱ�һ��ʱ,�¶�Խ���� SiHCl3��ת����Խ��,˵�������¶�ƽ��������Ӧ�����ƶ���B.�¶�һ��ʱ,Ͷ�ϱ�Խ��, SiHCl3��ת����Խ��,˵��![]() ��ֵԽ����C.�����¶�ƽ��������Ӧ�������,ƽ�ⳣ��������D.����ӦΪ�������ʵ�������ķ�Ӧ,����ѹǿ,ƽ�����淴Ӧ�����ƶ���
��ֵԽ����C.�����¶�ƽ��������Ӧ�������,ƽ�ⳣ��������D.����ӦΪ�������ʵ�������ķ�Ӧ,����ѹǿ,ƽ�����淴Ӧ�����ƶ���
��ͼ����֪��,Ͷ�ϱ�һ��ʱ,�¶�Խ��, SiHCl3��ת����Խ��,˵�������¶�ƽ��������Ӧ�����ƶ�,������ӦΪ���ȷ�Ӧ,A�������¶�һ��ʱ,Ͷ�ϱ�Խ��, SiHCl3��ת����Խ��,��![]() ��ֵԽ��, SiHCl3��ת����Խ��,˵��������Ϊ
��ֵԽ��, SiHCl3��ת����Խ��,˵��������Ϊ![]() ��B�����������¶�ƽ��������Ӧ�������,ƽ�ⳣ������,C��ȷ������ӦΪ�������ʵ�������ķ�Ӧ,����ѹǿ,ƽ�����淴Ӧ�����ƶ�, SiHCl3��ת���ʼ�С,D��������ȷѡ��C��
��B�����������¶�ƽ��������Ӧ�������,ƽ�ⳣ������,C��ȷ������ӦΪ�������ʵ�������ķ�Ӧ,����ѹǿ,ƽ�����淴Ӧ�����ƶ�, SiHCl3��ת���ʼ�С,D��������ȷѡ��C��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� B. ��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��һ����Ҫ�Ļ���ԭ�ϣ���֪����A�ڱ�״��������������ܶ�Ϊ13��B�ɷ���������Ӧ������֮���ת����ϵ����ͼ����ش�

��1���л���C�к��еĹ�����������________����Ӧ�۵ķ�Ӧ������____________��
��2����Ӧ�ٵ�ԭ�������ʴ�100%���÷�Ӧ�Ļ�ѧ����ʽ��______________________��
��3������˵����ȷ����__________________��
A����Ӧ��Ҳ��ʵ��ԭ��������100%
B����������������������Һ��ˮ��ķ�Ӧ����������Ӧ
C���л���A��B��C����ʹ���Ը��������Һ��ɫ
D���л���B��D�����������Ƽ���������ͭ����Һ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������·���ѩ�����dz�ʹ��һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1 mol XY2����54mol���ӡ�
��1������ѩ���Ļ�ѧʽ��____���������л�ѧ��������______������ʽ��______��
��2��Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D��Y���ڣ���D�����ӽṹʾ��ͼ��__________��D��E���γ�һ�ֽṹ������CO2����ԭ�ӷ��ӣ���ÿ��ԭ�Ӿ��ﵽ��8e���ȶ��ṹ���÷��ӵĽṹʽΪ_________������ʽΪ_______����ѧ������Ϊ_________(����Ӽ������Ǽ��Թ��ۼ������Թ��ۼ���)��
��3��W����Dͬ����Ķ�����Ԫ�أ�Z�ǵ������ڽ�������ǿ��Ԫ�أ�Z�ĵ�����W�ij��������з�Ӧʱ�����ֲ��������ʱ����____���仯ѧ������Ϊ___������ʱ����_____���仯ѧ������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�CO��g����H2O ��g��![]() CO2��g����H2��g����ƽ�ⳣ��K=1�����¶����������Ϊ1 L�ļס������������ܱ������У�Ͷ��CO��g����H2O��g������ʼŨ�ȼ�5 minʱ��Ũ�����±���ʾ��
CO2��g����H2��g����ƽ�ⳣ��K=1�����¶����������Ϊ1 L�ļס������������ܱ������У�Ͷ��CO��g����H2O��g������ʼŨ�ȼ�5 minʱ��Ũ�����±���ʾ��
�� | �� | |||
��ʼŨ�� | 5minʱŨ�� | ��ʼŨ�� | 5minʱŨ�� | |
c��CO��/mol/L | 0.1 | 0.08 | 0.2 | x |
c��H2O��/mol/L | 0.1 | 0.08 | 0.2 | y |
�����жϲ���ȷ����
A. x��y��0.16
B. ��Ӧ��ʼʱ�����з�Ӧ���ʱȼ�
C. ƽ��ʱ�����е�c��CO���Ǽ��е�2��
D. ƽ��ʱ������H2O��ת������50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Լ��ı��淽��������ǣ�������
A. ����������Һ�����ھ��в��������Լ�ƿ��
B. �������Ʊ�����ú����
C. ����������Һ����ڼ����������۵��Լ�ƿ��
D. Ũ���ᱣ������ɫ�����Լ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx��CO��SO2�ȴ�����Ⱦ����Ĵ�������������������о����ȵ����⡣
��1����֪��
I. 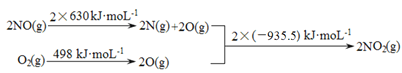
II. 2NO��g����O2��g�� ![]() 2NO2��g�� ��H1
2NO2��g�� ��H1
2SO2��g����O2��g�� ![]() 2SO3��g�� ��H2 =��196.6 kJ��mol-1
2SO3��g�� ��H2 =��196.6 kJ��mol-1
�� ��H1 =________________kJ��mol-1��
�� д��NO2������SO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽ________��
��2��ú̿ȼ�չ������ͷų�������SO2�������ƻ���̬������ȼ�չ����м���ʯ��ʯ������Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷţ��÷�Ӧ�Ļ�ѧ����ʽ��______��
��3��ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ������������Ч�ʡ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Ӧ��CaSO4��s����CO��g��![]() CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
��Ӧ��CaSO4��s����4CO��g��![]() CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
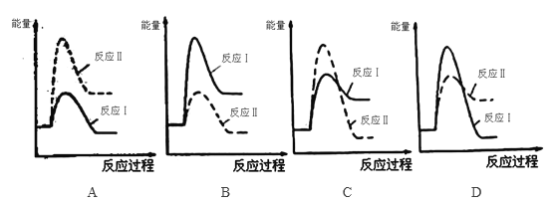
���ϣ��ٷ�Ӧ���ͷ�Ӧ��ͬʱ���� �ڷ�Ӧ�������ʴ��ڷ�Ӧ��������
��ش��������⣺
�� ���з�Ӧ���������仯ʾ��ͼ��ȷ����_______________��
�� ͼ1Ϊʵ���ò�ͬ�¶��·�Ӧ��ϵ��CO��ʼ����ٷ�����ƽ��ʱ���������CaS�����ٷ����Ĺ�ϵ���ߡ��÷�Ӧ��ϵ��SO2�������Ĵ�ʩ��_________������ĸ����
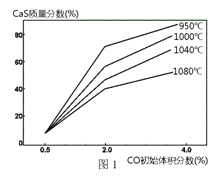
A. ��÷�Ӧ��ϵ��Ͷ��ʯ��ʯ
B. �ں��ʵ��¶������ڿ��ƽϵ͵ķ�Ӧ�¶�
C. ���CO�ij�ʼ����ٷ���
D. ��߷�Ӧ��ϵ���¶�
�� ͼ2��ʾ���º��������·�Ӧ��ϵ��c��SO2����ʱ��t�仯��������ͼ����ӻ�ѧ��Ӧԭ���ĽǶȽ���c��SO2�������Ӻ͵�ԭ��_______��
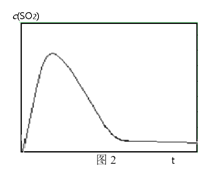
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��������У�2NO2 ![]() 2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
2NO��O2������˵����Ӧ��ƽ��״̬���ǣ�
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2�� �ڵ�λʱ��������n mol O2 ��ͬʱ������2n mol NO�� ��NO2��NO��O2 �ķ�Ӧ���ʵı�Ϊ2 : 2 : 1��״̬�� �ܻ���������ɫ���ٸı��״̬�� �ݻ��������ܶȲ��ٸı��״̬�� ��������ƽ����Է����������ٸı��״̬��
A. �٢ܢ�B. �ڢۢ�C. �٢ۢ�D. �٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݣ��ݴˣ�����˵����ȷ����

A. ����������ʵ���Ũ��Ϊ 9.2 mol/L
B. 1 mol Zn�������ĸ����ᷴӦ����2 g����
C. ����200 mL 4.6 mol/L��ϡ������ȡ������50 mL
D. ���������������ˮ���������Һ�����ʵ���Ũ�ȴ���9.2 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com