
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【答案】C
【解析】
试题由表可知平衡时,X的浓度变化量是0.05mol/L,Z的变化量是0.15mol/L,Z的变化量是0.1mol/L,反应的化学计量系数之比等于浓度变化量之比,参与反应的n(X) : n(Y) : n(Z) = 1:3:2,所以反应可以表示为X+3Y![]() 2Z。C项,该反应正反应方向是体积减小的反应,增大压强平衡右移,但是平衡常数不变,故C项错误;A项,平衡时X的转化率为0.05/0.1*100%=50%,故A项正确;B项,平衡常数K=(0.12)/(0.053*0.05)=1600,故B项正确;D项,平衡常数只与反应本身和温度有关,改变温度可以改变此反应的平衡常数,故D项正确。综上所述,本题正确答案为C。
2Z。C项,该反应正反应方向是体积减小的反应,增大压强平衡右移,但是平衡常数不变,故C项错误;A项,平衡时X的转化率为0.05/0.1*100%=50%,故A项正确;B项,平衡常数K=(0.12)/(0.053*0.05)=1600,故B项正确;D项,平衡常数只与反应本身和温度有关,改变温度可以改变此反应的平衡常数,故D项正确。综上所述,本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
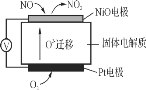
①Pt电极上发生的是_______(填“氧化”或“还原”)反应。
②写出NiO电极的电极反应式:___________________________________。
(2)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
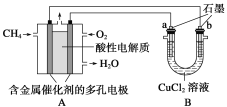
请回答:①甲烷燃料电池负极反应式是_______________________________________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有______,看到的现象是_______,反应的化学方程式为__________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是________,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. ![]()
(2)CH3COONH4的水溶液呈_______(选填酸性”、“中性"或“碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H=akJ/mol
CH3CH2OH(g)+3H2O(g) △H=akJ/mol
在一定压强下,测得.上述反应的实验数据如下表。

根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即![]() ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应为:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是
Si(s)+3HCl(g)。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是
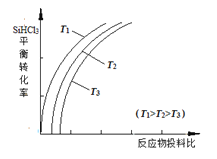
A. 该反应是放热反应
B. 横坐标表示的投料比应该是![]()
C. 该反应的平衡常数随温度升高而增大
D. 实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com