
【题目】亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有______,看到的现象是_______,反应的化学方程式为__________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是________,反应的化学方程式为___________。
【答案】Na2SO3溶液、溴水溴水褪色Na 2 SO 3 + Br 2 + H 2 O = Na 2 SO 4 +2HBrNa2SO3溶液、Na2S溶液和稀硫酸生成浅黄色沉淀2S2-+SO32-+6H+![]() 3S↓+3H2O
3S↓+3H2O
【解析】
(1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,可与亚硫酸钠发生氧化还原反应;
(2)要证明Na2SO3具有氧化性,题中具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应。
(1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,则选择的试剂为Na2SO3溶液、溴水,二者发生氧化还原反应,可观察到溴水褪色,反应的化学方程式为Na2SO 3 + Br2 + H2O = Na2SO 4 +2HBr,
因此,本题正确答案是:Na2SO3溶液、溴水;溴水褪色;Na2SO 3 + Br2 + H2O = Na2SO 4 +2HBr;
(2)要证明Na2SO3具有氧化性,题中具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应,反应的离子方程式为2S2-+SO32-+6H+![]() 3S↓+3H2O,可观察到生成浅黄色沉淀,
3S↓+3H2O,可观察到生成浅黄色沉淀,
因此,本题正确答案是:Na2SO3溶液、Na2S溶液和稀硫酸;生成浅黄色沉淀 ;2S2-+SO32-+6H+![]() 3S↓+3H2O。
3S↓+3H2O。


科目:高中化学 来源: 题型:
【题目】按下列要求填写以下空格:
(1)-COOH的名称是 ________________,
(2)-CHO的名称是___________________
(3)写出羟基的化学式_______________________
(4)苯的结构简式是_______________
(5)写出乙酸与碳酸钠反应的化学方程式______________________________________________ ,
该反应说明,乙酸的酸性____(填强或弱)于碳酸 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是___________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
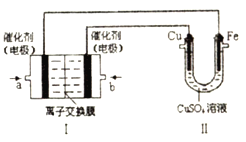
如图,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式是___________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为___________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=___________(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有金属元素的离子—定是阳离子
B. 含有离子键和共价键的化合物一定是离子化合物
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 第ⅦA族元素的阴离子还原性越强,其最高价氧化物的水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X____________________ Y___________________
Z____________________ W___________________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第IA族 B. 第四周期第IA族
C. 第五周期第IA族 D. 第二周期第IIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O (g)![]() CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 平衡时,乙中的c(CO)是甲中的2倍
D. 平衡时,乙中H2O的转化率是50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com