
【题目】以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图: 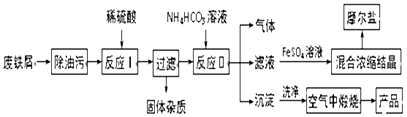
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式: .
(2)本流程中产生的CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4FeSO46H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4FeSO46H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c molL﹣1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
KMnO4溶液应盛装在滴定管中,滴定过程中发生反应的离子方程式为滴定终点的现象是通过实验数据计算的该产品纯度为(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
【答案】
(1)4FeCO3+O2 ![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(2)HCOOH(l)+ ![]() O2(g)═CO2(g)+H2O(g);△H=﹣254.6kJ/m
O2(g)═CO2(g)+H2O(g);△H=﹣254.6kJ/m
(3)D;酸式;MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O;最后一滴滴入,溶液由无色变为浅紫色,且30s不变色;![]() ;BC
;BC
【解析】解:废铁屑加入稀硫酸溶解过滤得到硫酸亚铁溶液和不溶性杂质,FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液和二氧化碳,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红,FeSO4溶液与(NH4)2SO4生成摩尔盐,(1)碳酸亚铁空气中受热得氧化铁和二氧化碳,反应方程式为:4FeCO3+O2 ![]() 2Fe2O3+4CO2;所以答案是:4FeCO3+O2
2Fe2O3+4CO2;所以答案是:4FeCO3+O2 ![]() 2Fe2O3+4CO2;(2)CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料为HCOOH,液体HCOOH的燃烧热为254.6 kJ/mol,则HCOOH完全燃烧的热化学方程式为:HCOOH(l)+
2Fe2O3+4CO2;(2)CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料为HCOOH,液体HCOOH的燃烧热为254.6 kJ/mol,则HCOOH完全燃烧的热化学方程式为:HCOOH(l)+ ![]() O2(g)═CO2(g)+H2O(g);△H=﹣254.6 kJ/mol;
O2(g)═CO2(g)+H2O(g);△H=﹣254.6 kJ/mol;
所以答案是:HCOOH(l)+ ![]() O2(g)═CO2(g)+H2O(g);△H=﹣254.6 kJ/mol;(3)①摩尔盐晶体不易被氧化,易溶于水,不溶于乙醇作答,所以选浓度较大的乙醇,减少物质的损失;
O2(g)═CO2(g)+H2O(g);△H=﹣254.6 kJ/mol;(3)①摩尔盐晶体不易被氧化,易溶于水,不溶于乙醇作答,所以选浓度较大的乙醇,减少物质的损失;
所以答案是:D;
②利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+↑1,Mn由+7价→+2↓5,最小公倍数5,根据原子个数、电荷守恒,即MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为 ![]() ═25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4)=25×10﹣3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O]=25×10﹣3×c×5×500/25mol=2.5cmol,所以质量分数=
═25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4)=25×10﹣3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O]=25×10﹣3×c×5×500/25mol=2.5cmol,所以质量分数= ![]() =
= ![]() ;
;
A、俯视读数,造成所读的数偏小,故A错误;
B、滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故B正确;
C、锥形瓶用待测液润洗,待测液的物质的量增加,则消耗高锰酸钾的体积增加,故C正确;
D、三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,故D错误.
故选BC;
所以答案是:酸式;MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O;最后一滴滴入,溶液由无色变为浅紫色,且30s不变色; ![]() ×100%;BC.
×100%;BC.


科目:高中化学 来源: 题型:
【题目】纯碱是造纸、玻璃、纺织、制革等行业的重要原料.
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成.第②步反应的化学方程式为 .
(2)①原盐水中含少量Mg2和Ca2 , 结合生产实际,精制盐水需要的试剂时、 . (填化学式)
②步骤 II保持在30﹣35℃进行,反应的化学方程式为 , 该反应能发生的原因是 . 该工艺中循环利用的物质是 .
③索尔维制纯碱不需要用到的一种设备是 (填正确答案标号).
A.吸氨塔 B.蒸氨塔 C.碳酸化塔 D.沸腾炉 E.石灰窑
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是 . 我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率.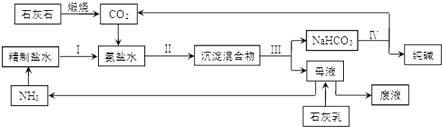
(3)纯碱产品中可能含有碳酸氢钠.用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NAHCO3)=(列出算式,所需数据用字母表示,并说明各字母的含义).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋是重要的调味品,我国劳动人民在很早以前就知道酒在空气中能“酸败成醋”,该事实的实质是
A. 酒中的乙醇挥发,使乙醇的含量降低B. 酒中的杂质腐败成酸
C. 酒中的乙醇被氧化成乙醛D. 酒中的乙醇被氧化成乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
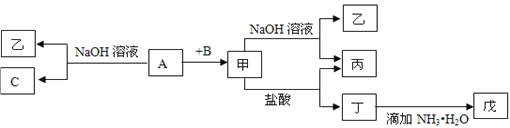
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:______________________________。
(3)写出甲→乙+丙反应的离子方程式:______________________________________;
丁→戊反应的离子方程式:___________________________________________;
A→乙+C反应的化学方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
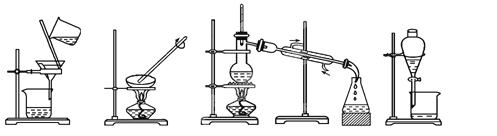
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
【题型】综合题
【结束】
18
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2 , CaC2再与水反应即得到乙炔.CaC2与水反应的化学方程式为
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H1=﹣890.3kJ/mol
C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=﹣1299.6kJ/mol
2H2 (g)+O2(g)=2H2O(l)△H3=﹣571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g) 的△H=kJ/mol
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)昀关系如图所示. 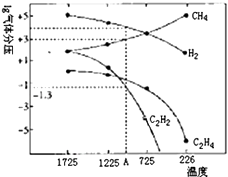
①T1℃时,向1L恒容密闭容器中充入0.3molCH4 只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得
c(C2H4)=c(CH4).该反应的△H(填“>”或“<”)0,CH4的平衡转化率为 . 上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1(填“>”或“<”) T2 , t=s.
②列式计算反应2CH4(g)=C2H2(g)+3H2(g),在图中A点温度时的平衡常数K=(用平衡分压代替平衡浓度计算,lg0.05=﹣1.3 )
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是一个基本物理量,表示物质所含粒子的多少
B. 1 mol氢中含有2 mol氢原子和2 mol电子
C. 摩尔是表示物质的数量的单位
D. 1 mol H2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com