
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2 , CaC2再与水反应即得到乙炔.CaC2与水反应的化学方程式为
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H1=﹣890.3kJ/mol
C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=﹣1299.6kJ/mol
2H2 (g)+O2(g)=2H2O(l)△H3=﹣571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g) 的△H=kJ/mol
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)昀关系如图所示. 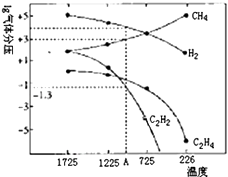
①T1℃时,向1L恒容密闭容器中充入0.3molCH4 只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得
c(C2H4)=c(CH4).该反应的△H(填“>”或“<”)0,CH4的平衡转化率为 . 上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1(填“>”或“<”) T2 , t=s.
②列式计算反应2CH4(g)=C2H2(g)+3H2(g),在图中A点温度时的平衡常数K=(用平衡分压代替平衡浓度计算,lg0.05=﹣1.3 )
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有 .
【答案】
(1)CaC2+2H2O→Ca(OH)2+C2H2↑
(2)+376.4
(3)>;66.7%;>;5;5×104;充入适量的乙烯
【解析】解:(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,所以答案是:CaC2+2H2O→Ca(OH)2+C2H2↑;(2)已知:①CH4(g)+2O2 (g)═CO2(g)+2H2O(l)△H=﹣890.3kJmol﹣1 .
②C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=﹣1299.6kJ/mol
③2H2 (g)+O2(g)=2H2O(l)△H3=﹣571.6kJ/mol,
将①×4﹣②﹣③× ![]() 可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(﹣890.3kJmol﹣1 )×4﹣(﹣1299.6kJmol﹣1)﹣(﹣571.6kJmol﹣1)×
可得:2CH4(g)=C2H2(g)+3H2 (g)△H=(﹣890.3kJmol﹣1 )×4﹣(﹣1299.6kJmol﹣1)﹣(﹣571.6kJmol﹣1)× ![]() =+376.4kJ/mol,
=+376.4kJ/mol,
所以答案是:+376.4kJ/mol;(3)①反应2CH4(g)=C2H4(g)+2H2(g)为分解反应,而分解反应绝大多数为吸热反应,故此反应为吸热反应;
设CH4的转化浓度为Xmol/L,可知:
2CH4(g) | = | C2H4(g)+ | 2H2(g) | |
初始浓度: | 0.3mol/L | 0 | 0 | |
浓度变化: | Xmol/L |
| Xmol/L | |
平衡浓度: | (0.3﹣X)mol/L |
| Xmol/L |
根据c(C2H4)=c(CH4)可知:0.3﹣X= ![]()
解得X=0.2mol/L;
故CH4的平衡转化率= ![]() ×100%=66.7%;
×100%=66.7%;
改变温度后,CH4的浓度升高,即平衡左移,即温度应为降低,即T1>T2;
由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在tS的时间内,CH4的浓度变化为0.01tmol/L,根据浓度的该变量之比等于计量数之比,利用三段式来计算:
2CH4(g) | = | C2H4(g)+ | 2H2(g) | |
初始浓度: | 0.1mol/L | 0.1mol/L | ||
浓度变化: | 0.01tmol/L | 0.005tmol/L | ||
平衡浓度: | (0.1+0.01t)mol/L | (0.1﹣0.005t)mol/L |
由于c(CH4)=2c(C2H4),故有:0.1+0.01t=2×(0.1﹣0.005t)
解得t=5S
所以答案是:>;66.7%;>;5;
②根据此反应的平衡常数表达式,将气体的平衡浓度换为平衡分压,即K= ![]() =
= ![]() =5×104 , 所以答案是:5×104;
=5×104 , 所以答案是:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,所以答案是:可以充入适量的乙烯.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
温度( | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10﹣8 mol3L﹣3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 ![]() 时,达平衡时,X分解了 0.03 mol
时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图: 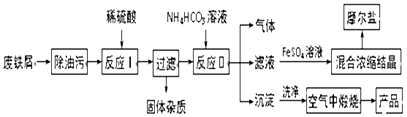
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式: .
(2)本流程中产生的CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4FeSO46H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4FeSO46H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c molL﹣1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
KMnO4溶液应盛装在滴定管中,滴定过程中发生反应的离子方程式为滴定终点的现象是通过实验数据计算的该产品纯度为(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=﹣1200kJmol﹣1 , 温度不同 (T2>T1)其他条件相同时,下列图象正确的是( )
A.
B.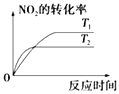
C.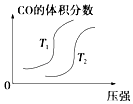
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42﹣的物质的量浓度为( )
A.0.9 mol/L
B.1.8 mol/L
C.0.7mol/L
D.0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%浓硫酸配制0.1mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )
A.未冷却就转移、定容
B.容量瓶内原有少量蒸馏水
C.定容时俯视刻度线观察液面
D.定容时加多了水再用吸管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用化学方法除去下列物质中混有的少量杂质,写出有关反应的化学方程式.
①铜粉中混有少量的氧化铜
②硝酸中混有少量的硫酸
③氢氧化钠中混有少量的碳酸钠
④氧化钙中混有少量的碳酸钙
⑤硫酸钠中混有少量的氧化钠.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质燃烧时火焰颜色描述错误的是 ( )
A.氢气在氯气中燃烧——苍白色B.钠在空气中燃烧——黄色
C.乙醇在空气中燃烧——淡蓝色D.硫在氧气中燃烧——绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com