
【题目】用98%浓硫酸配制0.1mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )
A.未冷却就转移、定容
B.容量瓶内原有少量蒸馏水
C.定容时俯视刻度线观察液面
D.定容时加多了水再用吸管吸出
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( ) 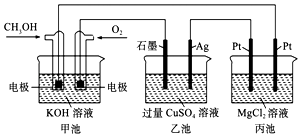
A.甲池中阳离子向通入CH3OH一方的电极区域内移动
B.甲池通入CH3OH的电极反应式为CH3OH﹣6e﹣+2H2O═CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2 , 此时丙池中理论上产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产.
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2 , CaC2再与水反应即得到乙炔.CaC2与水反应的化学方程式为
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H1=﹣890.3kJ/mol
C2H2(g)+2.5O2(g)=2CO2 (g)+H2O(l)△H2=﹣1299.6kJ/mol
2H2 (g)+O2(g)=2H2O(l)△H3=﹣571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g) 的△H=kJ/mol
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)昀关系如图所示. 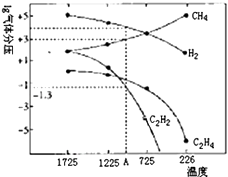
①T1℃时,向1L恒容密闭容器中充入0.3molCH4 只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得
c(C2H4)=c(CH4).该反应的△H(填“>”或“<”)0,CH4的平衡转化率为 . 上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1(填“>”或“<”) T2 , t=s.
②列式计算反应2CH4(g)=C2H2(g)+3H2(g),在图中A点温度时的平衡常数K=(用平衡分压代替平衡浓度计算,lg0.05=﹣1.3 )
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
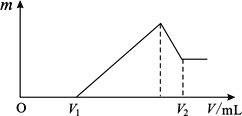
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素中,占细胞总量97%的一组是( )
A. C、H、O、N、P、S
B. C、Fe、K、Ca、B、Mg
C. N、P、S、K、Ca、Mg
D. Fe、Mn、B、Zn、Cu、Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
已知:①溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
②氯水为氯气的水溶液。
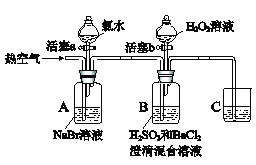
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为橙黄色 |
Ⅱ | 吹入热空气 | A中橙黄色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色 |
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________。
(2)实验操作II吹入热空气的目的是___________________________________。
(3)装置C的作用是_____________________________________。
(4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是____________。
(5)由操作I得出的结论是_____________,由操作III得出的结论是______________。
(6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com