
����Ŀ�����ʻ�ѧ����й������ں��ǡ���ѧ-----���ǵ�������ǵ�δ������ѧϰ��ѧӦ�����ס���������������������ȥ������������գ�
��1�����������ƵȻ��ý����Ż�ʱ��Ӧ��_______________�������
�ھ��������գ���ɫ��ӦΪdz��ɫ������ɫ�ܲ�������Ԫ���ǡ�_______________
��θ��ƽ����������������������θ����࣬�䷴Ӧ�����ӷ�Ӧ����ʽΪ��_______________��
�������ܾ�ˮ������뷽��ʽ��_______________��
��2������������DZͧ������ʱ�����Ļ�ѧ��Ӧ����ʽ��_____________��
��3������AlƬ��ʵ��������_________________��ԭ����_____________��
���𰸡� ��ɳ�� K Al(OH)3 + 3H�� ��Al3+ + 3H2O KAl(SO4)2 ��K++ Al3+ + 2SO42�� 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 ��Ƭ�ڻ������Dz����� �������۵�������������������档
2Na2CO3+ O2 ��Ƭ�ڻ������Dz����� �������۵�������������������档
����������1�������Ż����ɹ������ƣ����������̼��ˮ��Ӧ����������������ˮ��Ӧ�����������������ƵȻ��ý����Ż�ʱ��Ӧ���ø�ɳ����𣻢ں�KԪ�ص�������ɫ��ӦΪdz��ɫ������ɫ�ܲ���������������������θ�ᣨ���ᣩ��������ӷ�Ӧ����ʽΪ��Al(OH)3+3H+=Al3++3H2O����������KAl(SO4)212H2O������ˮ���KAl(SO4)2��Һ������Һ������ȫ����Ϊ�����ӡ������Ӻ���������ʵ��뷽��ʽΪ��KAl(SO4)2�TK++Al3++2SO42������2������������DZͧ������ʱ�����Ļ�ѧ��Ӧ����ʽ��2Na2O2 + 2CO2![]() 2Na2CO3+ O2����3������AlƬ��ʵ����������Ƭ�ڻ������Dz����䣬ԭ�����������۵����������������������
2Na2CO3+ O2����3������AlƬ��ʵ����������Ƭ�ڻ������Dz����䣬ԭ�����������۵����������������������
�����͡������
��������
20
����Ŀ����þ�����Ļ���ﹲ0.2mol������200mL4mol��L��1��������Һ�У�Ȼ���ٵμ�2mol��L��1��NaOH��Һ����ش��������⣺
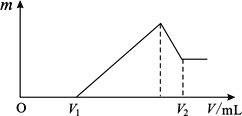
��1�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯�����ͼ��ʾ����V1=160mLʱ���������ĩ��n(Mg)=_______________mol��
��2��0~V1�η����ķ�Ӧ�����ӷ���ʽΪ_______________��
��3�����ڵμ�NaOH��Һ�Ĺ����У���ʹMg2+��Al3+ �պó�����ȫ�������NaOH��Һ�����V(NaOH)=_______________mL��
��4���Լ���V2��ֵ�� V2=_______________mL��
���𰸡� 0.12 H++OH-��H2O 400 440
�������������������0~V1��û�г������ɣ���NaOH��Һ����������ᷴӦn(HCl)=n(NaOH)=0.16L3mol/L=0.32mol,��ô��þ�����Ļ���ﷴӦ����������ʵ���Ϊ��0.2L��4mol��L��1-0.32mol=0.48mol��(1)��þ���������ʵ����ֱ�Ϊxmol��ymol�����ݣ�Mg +2 H+��Mg 2++H2��,2Al + 6H+��Al3++ 3H2��,
x 2x y 3y
���У�x+y=0.2 2x + 3y=0.48 �ã�x="0.12" mol y=0.08mol����2��0~V1����NaOH��Һ����������ᷴӦ�����ӷ���ʽΪ��H++OH-��H2O��3��Mg 2++2OH-��Mg(OH)2��, Al3++ 3 OH-��Al(OH)3��, 0.12 mol ��Mg 2+��0.08mol��Al3+�պó�����Ҫ��NaOH���ʵ���Ϊ��0.12mol��2+0.08mol��3=0.48mol���ܹ���Ҫ��NaOH�����ʵ���Ϊ��0.48mol+0.32mol=0.8mol��NaOH��Һ�����Ϊ��0.8mol��2mol��L="0.4L=400" mL��(4)��������NaOH��Һ��Al(OH)3�����ܽ⣬0.08mol��Al(OH)3�ܽ���Ҫ0.08mol��NaOH���ʵ���Ϊ��0.08mol ��Al(OH)3�պ��ܽ����ĵ�NaOH�����ʵ���Ϊ��0.8+0.08=0.88mol�����Ϊ��0.88mol��2mol��L="0.44L=440" mL��


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KCl��MgCl2��Mg��NO3��2�γɵĻ����Һ�У�c��K+��=0.1mol/L��c��Mg2+��=0.15mol/L��c��Cl����=0.2mol/L����c��NO3����Ϊ�� ��
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������֪��2SO2+O22SO3������Ӧ�����е�������ϵ������ͼ��ʾ��ͼ�еġ�H ��ʾ����1mol��������ݣ��� ����˵����ȷ���ǣ� �� 
A.S8��ȼ���ȡ�H=��a kJmol��1
B.1 mol SO2���� O2��Ӧ���ͷų� b kJ ������
C.��֪1��S8��������8��S��S��S=O�ļ���Ϊd kJmol��1 �� O=O�ļ���Ϊe kJmol��1 �� ��S8������S��S�ļ���Ϊ��2d��a��e�� kJmol��1
D.��ʹ��V2O5����������SO2��g��ת������1mol SO3��g��ʱ���ͷŵ�����С��b kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��4CO��g��+2NO2��g��=4CO2��g��+N2��g����H=��1200kJmol��1 �� �¶Ȳ�ͬ ��T2��T1������������ͬʱ������ͼ����ȷ���ǣ� ��
A.
B.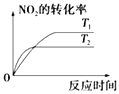
C.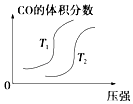
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ͽ�1 mol H2�еĻ�ѧ����Ҫ����436kJ���������Ͽ�1 mol Cl2�еĻ�ѧ����Ҫ����243kJ�����������γ�1mol HCl�����еĻ�ѧҪ�ͷ�431kJ����������1mol������1mol������Ӧʱ�����仯Ϊ��
A. ����183kJB. ����366kJC. �ų�366kJD. �ų�183kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%Ũ��������0.1mol/L��ϡ���ᣬ���������ʹ������ҺŨ��ƫ�͵��ǣ� ��
A.δ��ȴ��ת�ơ�����
B.����ƿ��ԭ����������ˮ
C.����ʱ���ӿ̶��߹۲�Һ��
D.����ʱ�Ӷ���ˮ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����������KMnO4��H2C2O4��Ӧͨ���ⶨ��λʱ�������� CO2������̽��Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�������
ʵ����� | A ��Һ | B ��Һ |
�� | 20 mL 0.1 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1KMnO4 ������Һ |
�� | 20 mL 0.2 molL��1 H2C2O4 ��Һ | 30 mL 0.01 molL��1 KMnO4������Һ |

��1��������ͼװ�������Ե����㷽��Ϊ�� ��
��2��H2C2O��Һ������ KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죬��ͬʱ������Ͳ������CO2�������С��ϵ������ʵ����ţ���
��4����ʵ�����2minĩ�ռ���4.48mL CO2����״���£�������2minĩ��c��MnO4����=����������Һ���ǰ������ı仯����
��5��С��ͬѧ���ַ�Ӧ����������ͼ��ʾ������̽��t1��t2ʱ�������ʱ�����Ҫԭ�������������ǣ�����������K+�Ը÷�Ӧ�д����ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ��ǿ������Ư�����㷺���ڷ�֯��ӡȾ��ʳƷ��ҵ�����ڼ��Ի������ȶ����ڡ�ijͬѧ�������Ϻ��������NaClO2����Ҫ�������¡������ֲ�Ʒδ�����
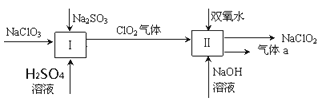
��1�����з�����Ӧ�Ļ�ԭ����____________�����е���������________���ѧʽ����
��2�����з�Ӧ�����ӷ���ʽ��______________________________________��
��3��ClO2��һ�ָ�Чˮ�������������������ƺ�ϡ����Ϊԭ���Ʊ���5NaClO2 + 4HCl = 5NaCl + 4ClO2��+ 2H2O��
�ٸ÷�Ӧ���������ͻ�ԭ�������ʵ���֮����________��
���о������������������лᷢ������Ӧ��NaClO2 + 4HCl = NaCl + 2Cl2��+ 2H2O������Ӧ��ʼʱ����Ũ��Խ�������������Cl2�ĺ���Խ�����Ʋ���ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mLijŨ�ȵ�������Һ�е���0.1moll��1��ˮ����Һ��ˮ�����������Ũ������백ˮ������仯��ͼ�����з�����ȷ���ǣ� �� 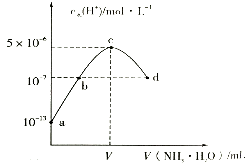
A.V=40
B.C����ʾ��Һ�У�c��H+����c��OH�����T2c��NH3H2O��
C.d����ʾ��Һ�У�c��NH4+���T2c��SO42����
D.NH3H2O�ĵ��볣��K=10��4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com