
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
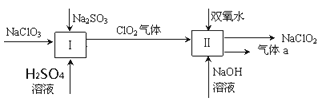
(1)Ⅰ中发生反应的还原剂是____________、Ⅱ中的氧化剂是________(填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是__________。
【答案】 Na2SO3 ClO2 2ClO2 + 2H2O2 +2OH- == 2ClO2- + O2 + 2H2O 1:4 ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2。
【解析】(1)I中NaClO3转化为ClO2,Cl元素化合价由+5价降到+4价,NaClO3得电子,作氧化剂;根据得电子守恒,Na2SO3失电子,化合价降低,作还原剂。Ⅱ中ClO2转化为NaClO2,Cl元素化合价降低,则ClO2得电子,作氧化剂。
故答案为:Na2SO3;ClO2;
(2)Ⅱ中ClO2转化为NaClO2,Cl元素化合价降低,ClO2作氧化剂,则H2O2作还原剂,化合价升高,生成O2,则有ClO2+ H2O2—O2↑+ ClO2,溶液中加入了NaOH,配平方程式可得:2ClO2 + 2H2O2 +2OH- =2ClO2- +O2 + 2H2O;
故答案为:2ClO2 + 2H2O2 +2OH- =2ClO2- + O2 + 2H2O;
(3)① 反应5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O,NaClO2中Cl元素化合价由+3价分别变为—1价和+4价,NaClO2既是氧化剂又是还原剂,氧化剂和还原剂物质的量之比是1∶4。
故答案为:1∶4;
②NaClO2+4HCl=NaCl+2Cl2↑+2H2O,反应中,NaClO2作氧化剂,HCl作还原剂,反应开始时,盐酸浓度越大,溶液酸性越强,气体产物的含量增大。可能原因是,溶液酸性增强,导致NaClO2的氧化性增强,Cl-的还原性增强;或者Cl- 的浓度增大,导致Cl-还原性增强。
故答案为:ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2。


科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,所得的溶液中仍含有0.02mol的NaOH ,然后向溶液中逐滴加入lmol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
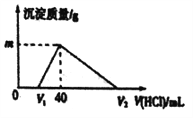
A. 原合金质量为0.92g B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL D. 图中m的值为1.56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
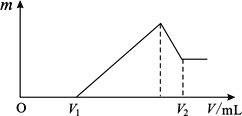
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素中,占细胞总量97%的一组是( )
A. C、H、O、N、P、S
B. C、Fe、K、Ca、B、Mg
C. N、P、S、K、Ca、Mg
D. Fe、Mn、B、Zn、Cu、Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
已知:①溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
②氯水为氯气的水溶液。
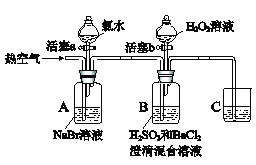
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为橙黄色 |
Ⅱ | 吹入热空气 | A中橙黄色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色 |
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________。
(2)实验操作II吹入热空气的目的是___________________________________。
(3)装置C的作用是_____________________________________。
(4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是____________。
(5)由操作I得出的结论是_____________,由操作III得出的结论是______________。
(6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、AlO2-、CO32-B.K+、Ba2+、SO42-
C.NH4+、OH-、NO3-D.Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100 mL 0.10 molL-1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:

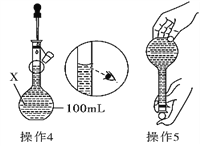
(1)仪器X的名称是_________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)配制一定物质的量浓度溶液时,会导致所配溶液浓度偏小的操作是________
A.定容时仰视刻度线
B.定容时俯视刻度线
C.在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌 ![]() 氢气
氢气 ![]() 铜
铜
(2)氧化铜 ![]() 硫酸铜
硫酸铜 ![]()
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
A.消耗相同质量的硫酸
B.消耗相同质量的锌
C.消耗相同质量的氧化铜
D.生成的硫酸锌质量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com