
【题目】某同学欲配制100 mL 0.10 molL-1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:

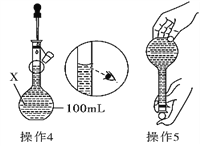
(1)仪器X的名称是_________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)配制一定物质的量浓度溶液时,会导致所配溶液浓度偏小的操作是________
A.定容时仰视刻度线
B.定容时俯视刻度线
C.在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=﹣1200kJmol﹣1 , 温度不同 (T2>T1)其他条件相同时,下列图象正确的是( )
A.
B.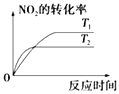
C.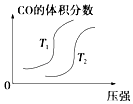
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
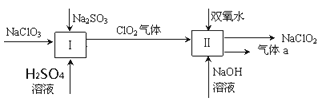
(1)Ⅰ中发生反应的还原剂是____________、Ⅱ中的氧化剂是________(填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物及其作用,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子,请回答:
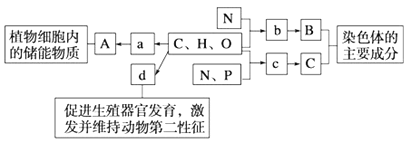
(1)真核细胞中,染色体位于___中,物质d的名称是___.
(2)物质b的结构通式为___,b之间发生脱水缩合的场所是___(细胞器).
(3)组成物质c的含氮碱基有腺嘌呤、鸟嘌呤、胞嘧啶和___.
(4)物质A为淀粉,组成淀粉的基本单位是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu3P中P为﹣3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中,
①被氧化的P和被还原的P的物质的量之比为;
②上述反应中7.5mol CuSO4氧化的P原子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质燃烧时火焰颜色描述错误的是 ( )
A.氢气在氯气中燃烧——苍白色B.钠在空气中燃烧——黄色
C.乙醇在空气中燃烧——淡蓝色D.硫在氧气中燃烧——绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1moll﹣1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( ) 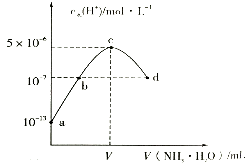
A.V=40
B.C点所示溶液中:c(H+)﹣c(OH﹣)═2c(NH3H2O)
C.d点所示溶液中:c(NH4+)═2c(SO42﹣)
D.NH3H2O的电离常数K=10﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、磷等单质及其化合物的反应有重要意义.
(1)试判断用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下能否自发进行(填“能”或“否”).已知:在298K、100kPa下该反应的△H=﹣113.0kJmol﹣1 , △S=﹣145.3Jmol﹣1K﹣1 .
(2)25℃下,将a molL﹣1的氨水与0.005molL﹣1的硫酸等体积混合,反应平衡时溶液中c(NH4+)=2c(SO42﹣),用含a的代数式表示NH3H2O的电离常数Kb= .
(3)25℃时,Ksp(BaSO4)=1.1×10﹣10 , Ksp(BaCO3)=2.6×10﹣9 , 现将BaCl2溶液滴入浓度均为0.01molL﹣1的Na2SO4和Na2CO3的混合溶液中,当两种沉淀共存时,溶液中c (CO32﹣):c(SO42﹣)=(不考虑CO32﹣的水解)
(4)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式: .
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH﹣)﹣c(H3PO2)= . 该温度下将pH=a的盐酸Vaml与pH=b的氢氧化钠Vbml混合后溶液呈中性,且a+b=10,则Va:Vb= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com