
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1moll﹣1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( ) 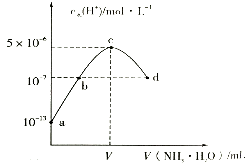
A.V=40
B.C点所示溶液中:c(H+)﹣c(OH﹣)═2c(NH3H2O)
C.d点所示溶液中:c(NH4+)═2c(SO42﹣)
D.NH3H2O的电离常数K=10﹣4
【答案】C
【解析】解:A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,所以氨水的体积也是20mL,即V=20,故A错误; B.c点所示溶液是硫酸铵溶液,溶液中质子守恒:c(H+)=c(NH3 . H2O)+c(OH﹣),所以溶液中存在:c(H+)﹣c(OH﹣)=c(NH3 . H2O),故B错误;
C.根据电荷守恒:c(H+)+c(NH4+)=2c(SO42﹣)+c(OH﹣),而溶液呈中性c(OH﹣)=c(H+),所以c(NH4+)=2c(SO42﹣),故C正确;
D.加入20mL氨水时两溶液恰好反应,此时c(H+)=5×10﹣6mol/L,c(OH﹣)=2×10﹣9mol/L,由于溶液中氢离子主要是铵根离子水解生成的,则c(NH3 . H2O)≈c(H+)=5×10﹣6mol/L,铵根离子水解程度较小,则c(NH4+)≈0.05mol/L,所以常温下0.1mol/L的氨水的Ka=2×10﹣5 , 故D错误.
故选C.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
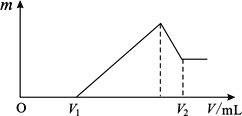
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A.H+、AlO2-、CO32-B.K+、Ba2+、SO42-
C.NH4+、OH-、NO3-D.Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100 mL 0.10 molL-1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:

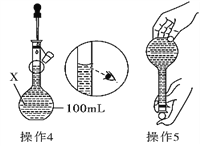
(1)仪器X的名称是_________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)配制一定物质的量浓度溶液时,会导致所配溶液浓度偏小的操作是________
A.定容时仰视刻度线
B.定容时俯视刻度线
C.在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
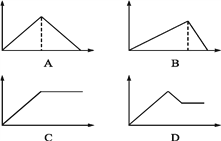
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌 ![]() 氢气
氢气 ![]() 铜
铜
(2)氧化铜 ![]() 硫酸铜
硫酸铜 ![]()
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
A.消耗相同质量的硫酸
B.消耗相同质量的锌
C.消耗相同质量的氧化铜
D.生成的硫酸锌质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,如图1是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用且最灵敏的检验试剂为(填试剂的名称).
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为: .
(3)称量上述含铁元素质量分数为20.00%的“速力菲”19.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液.取出20.00mL,用0.01300mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如图2所示.
①实验前,首先要精确配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 .
②某同学的滴定方式(夹持部分略去)如图,最合理的是 . 
③由图可知消耗KMnO4溶液体积为mL;
④滴定终点观察到的现象为;
⑤以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是 .
A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出
B.未用标准KMnO4溶液润洗滴定管
C.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
D.滴定前仰视,滴定后俯视(标准液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com