
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,如图1是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用且最灵敏的检验试剂为(填试剂的名称).
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为: .
(3)称量上述含铁元素质量分数为20.00%的“速力菲”19.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液.取出20.00mL,用0.01300mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如图2所示.
①实验前,首先要精确配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 .
②某同学的滴定方式(夹持部分略去)如图,最合理的是 . 
③由图可知消耗KMnO4溶液体积为mL;
④滴定终点观察到的现象为;
⑤以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是 .
A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出
B.未用标准KMnO4溶液润洗滴定管
C.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
D.滴定前仰视,滴定后俯视(标准液)
【答案】
(1)硫氰化钾溶液
(2)8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O
(3)250ml容量瓶;b;19.00;滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点;AD
【解析】解:(1)Fe2+氧化会生成Fe3+ , 可用硫氰化钾溶液检验Fe3+的存在,溶液变成血红色,所以答案是:硫氰化钾溶液;(2)MnO4﹣具有氧化性能将Fe2+氧化生成Fe3+ , 自身被还原成Mn2+ , 反应的离子方程式为:8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O,所以答案是:8H++MnO4﹣+5Fe2+=5Fe3++Mn2++4H2O;(3)①配制0.01300mol/L KMnO4溶液250mL,配制时需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,所以答案是:250mL容量瓶;②根据题意用标准液高锰酸钾滴定滤液1,滤液1待测液用锥形瓶盛放,高锰酸钾具有强氧化性,会腐蚀橡胶,应装在酸式滴定管中,b符合,所以答案是:b;③滴定前读数是0.80mL,滴定终点读数是19.80mL,则消耗KMnO4溶液体积为19.80mL﹣0.80mL=19.00mL,所以答案是:19.00;④KMnO4溶液呈紫红色,硫酸亚铁反应完毕,滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点,所以答案是:滴入最后一滴KMnO4溶液,溶液由浅绿色变为紫红色,且半分钟内颜色不再改变滴定达到终点;⑤A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出,待测液的物质的量偏小,造成V(标准)偏小,则c(待测)偏小,故A正确; B.未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,c(待测)偏大,故B错误; C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁,待测液的物质的量不变,对V(标准)无影响,c(待测)不变,故C错误; D.滴定前仰视,滴定后俯视(标准液),造成V(标准)偏小,则c(待测)偏小,故D正确;所以答案是:AD.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1moll﹣1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( ) 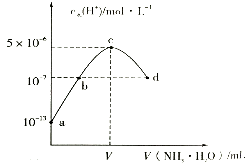
A.V=40
B.C点所示溶液中:c(H+)﹣c(OH﹣)═2c(NH3H2O)
C.d点所示溶液中:c(NH4+)═2c(SO42﹣)
D.NH3H2O的电离常数K=10﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标准状况下,某气体的体积为33.6L,气体的物质的量是 , 若是CO2气体,则该气体的质量是 , 若是CO和CO2气体总中质量为58克,其中氧原子个数是NA , 混合气体中碳氧原子个数比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、磷等单质及其化合物的反应有重要意义.
(1)试判断用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下能否自发进行(填“能”或“否”).已知:在298K、100kPa下该反应的△H=﹣113.0kJmol﹣1 , △S=﹣145.3Jmol﹣1K﹣1 .
(2)25℃下,将a molL﹣1的氨水与0.005molL﹣1的硫酸等体积混合,反应平衡时溶液中c(NH4+)=2c(SO42﹣),用含a的代数式表示NH3H2O的电离常数Kb= .
(3)25℃时,Ksp(BaSO4)=1.1×10﹣10 , Ksp(BaCO3)=2.6×10﹣9 , 现将BaCl2溶液滴入浓度均为0.01molL﹣1的Na2SO4和Na2CO3的混合溶液中,当两种沉淀共存时,溶液中c (CO32﹣):c(SO42﹣)=(不考虑CO32﹣的水解)
(4)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式: .
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH﹣)﹣c(H3PO2)= . 该温度下将pH=a的盐酸Vaml与pH=b的氢氧化钠Vbml混合后溶液呈中性,且a+b=10,则Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质,按单质、氧化物、酸、碱、盐分类顺序排列正确的是( )
A. 银、二氧化硫、硫酸、纯碱、食盐
B. 碘酒、冰、硫酸氢钠、烧碱、碳酸钙
C. 氢气、干冰、硝酸、烧碱、硝酸钾
D. 铜、氧化铜、醋酸、石灰水、碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为:______________________________ ,用硫酸亚铁晶体配制FeSO4溶液时你觉得还需加入少量的____________,防止FeSO4被氧化。
(2) 向FeCl3溶液中滴加KSCN溶液,溶液呈____色。
(3) 某气态氧化物化学式为RO2,在标准状况下,0.92g该氧化物的体积是448mL,则氧化物的相对分子质量为_________,R的摩尔质量为_______。
(4) 48g SO42-中含有的电子数为_________。
(5) NaClO2+4HCl(浓) ![]() NaCl+2Cl2↑+2H2O,此反应的氧化产物与还原产物的物质的量之比是____________,生成标准状况下4.48 L Cl2时,转移的电子数为_______。
NaCl+2Cl2↑+2H2O,此反应的氧化产物与还原产物的物质的量之比是____________,生成标准状况下4.48 L Cl2时,转移的电子数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。下列操作顺序中最合适的是
A. ①④②⑤③ B. ④①②⑤③ C. ②⑤④①③ D. ⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
(1)氧化剂与还原剂的物质的量之比是_________,HCl在反应中表现的性质有____________。
(2)单线桥标明该反应电子转移方向和数目:________________________。
(3)写出以软锰矿为原料制备Cl2的化学方程式___________________。
Ⅱ.(1)VLFe2(SO4)3溶液中含Fe3+ag,则该溶液中溶质的物质的量浓度为______________。
(2)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,分配结果是:
第一组:_______________;第二组:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com