
【题目】下列离子在溶液中能大量共存的是( )
A.H+、AlO2-、CO32-B.K+、Ba2+、SO42-
C.NH4+、OH-、NO3-D.Fe3+、NO3-、Cl-
科目:高中化学 来源: 题型:
【题目】在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O22SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( ) 
A.S8的燃烧热△H=﹣a kJmol﹣1
B.1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C.已知1个S8分子中有8个S﹣S,S=O的键能为d kJmol﹣1 , O=O的键能为e kJmol﹣1 , 则S8分子中S﹣S的键能为(2d﹣a﹣e) kJmol﹣1
D.若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
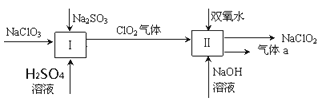
(1)Ⅰ中发生反应的还原剂是____________、Ⅱ中的氧化剂是________(填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15.8g KMnO4氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl,反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)该盐酸中HCl的物质的量浓度是______________________________。
(2)被氧化的HCl的物质的量为________________________。
(3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物及其作用,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子,请回答:
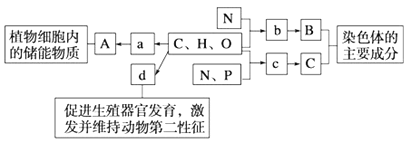
(1)真核细胞中,染色体位于___中,物质d的名称是___.
(2)物质b的结构通式为___,b之间发生脱水缩合的场所是___(细胞器).
(3)组成物质c的含氮碱基有腺嘌呤、鸟嘌呤、胞嘧啶和___.
(4)物质A为淀粉,组成淀粉的基本单位是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu3P中P为﹣3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中,
①被氧化的P和被还原的P的物质的量之比为;
②上述反应中7.5mol CuSO4氧化的P原子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1moll﹣1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( ) 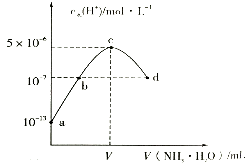
A.V=40
B.C点所示溶液中:c(H+)﹣c(OH﹣)═2c(NH3H2O)
C.d点所示溶液中:c(NH4+)═2c(SO42﹣)
D.NH3H2O的电离常数K=10﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标准状况下,某气体的体积为33.6L,气体的物质的量是 , 若是CO2气体,则该气体的质量是 , 若是CO和CO2气体总中质量为58克,其中氧原子个数是NA , 混合气体中碳氧原子个数比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com