
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,所得的溶液中仍含有0.02mol的NaOH ,然后向溶液中逐滴加入lmol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
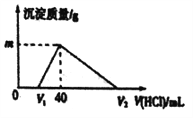
A. 原合金质量为0.92g B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL D. 图中m的值为1.56g
【答案】D
【解析】反应后所得的溶液中仍含有0.02mol的NaOH,所以需要1mol/L的盐酸20mL来中和,因此V1为20mL,继续加盐酸发生AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,因此沉淀AlO2-用掉20mL盐酸,溶解Al(OH)3用掉60mL盐酸,所以V2为100mL,(选项B错误);所以Al(OH)3为0.02mol,则m为1.56g,(选项D正确);原混合物中含有Al为0.54g,当盐酸加100mL时,溶液中的溶质为NaCl和AlCl3,又知n(Cl-)=0.1mol,n(Al3+)=0.02mol,所以n(Na+)=0.04mol。所以原混合物中有Na为0.04mol,质量为0.92g,所以原混合物的质量为0.92g+0.54g=1.46g(选项A错误)。反应过程中产生氢气0.05mol,标准状况下为1120mL(题中没给定标准状况下,选项C错误)。答案选D。


科目:高中化学 来源: 题型:
【题目】对药物的认识和使用正确的是
A. 感冒时服用适量阿司匹林B. 大部分药物没有副作用
C. 创可贴能用于伤口消炎D. 胃酸过多只要冲服板蓝根冲剂即可治愈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①大豆油和氯化钠溶液 ②39%的乙醇溶液 ③硫酸钠和单质溴的水溶 液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 1molSO2的质量为64 g·mol-1
C. 12 g 12C中所含碳原子数即为阿伏加德罗常数
D. 气体的摩尔体积约为22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
温度( | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10﹣8 mol3L﹣3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 ![]() 时,达平衡时,X分解了 0.03 mol
时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O22SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( ) 
A.S8的燃烧热△H=﹣a kJmol﹣1
B.1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C.已知1个S8分子中有8个S﹣S,S=O的键能为d kJmol﹣1 , O=O的键能为e kJmol﹣1 , 则S8分子中S﹣S的键能为(2d﹣a﹣e) kJmol﹣1
D.若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=﹣1200kJmol﹣1 , 温度不同 (T2>T1)其他条件相同时,下列图象正确的是( )
A.
B.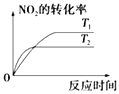
C.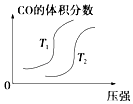
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
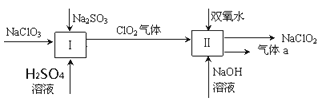
(1)Ⅰ中发生反应的还原剂是____________、Ⅱ中的氧化剂是________(填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com