
【题目】下列变化需克服共价键的是
A.金刚石熔化B.汞受热变成汞蒸气C.蔗糖溶于水D.食盐溶于水
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 1molSO2的质量为64 g·mol-1
C. 12 g 12C中所含碳原子数即为阿伏加德罗常数
D. 气体的摩尔体积约为22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
A. 吸收183kJB. 吸收366kJC. 放出366kJD. 放出183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
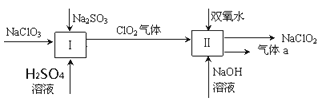
(1)Ⅰ中发生反应的还原剂是____________、Ⅱ中的氧化剂是________(填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15.8g KMnO4氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl,反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)该盐酸中HCl的物质的量浓度是______________________________。
(2)被氧化的HCl的物质的量为________________________。
(3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu3P中P为﹣3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中,
①被氧化的P和被还原的P的物质的量之比为;
②上述反应中7.5mol CuSO4氧化的P原子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间的反应与反应类型不相符的是( )
A. 乙烯与溴水(加成反应)B. 苯与浓硝酸(取代反应)
C. 乙醇与乙酸((酯化反应)D. 乙醇与氧气(取代反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com