
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
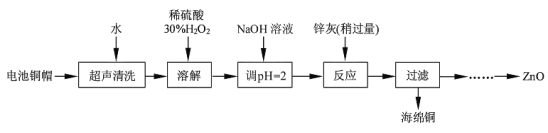
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式____;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为____,滴定终点观察到的现象为___;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为____(结果保留四位有效数字),若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会____(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。计算沉淀生成的溶液的pH= ___(假设Cu2+被完全沉淀,混合后溶液体积不发生变化);
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入适量30% H2O2,使其充分反应;
②_______;
③过滤;
④______;
⑤过滤、洗涤、干燥;
⑥900℃煅烧。
【答案】Cu+H2O2+2H+=Cu2++2H2O 淀粉溶液 滴入最后一滴标准溶液,溶液由蓝色变为无色,且30s内不恢复 80.99﹪或 0.8099 偏高 9 滴加1.0 mol·L-1NaOH,调溶液pH为3.2≤pH<5.9,使Fe3+沉淀完全 向滤液中滴加1. 0 mol·L-1NaOH,调节溶液pH 为8. 9≤pH≤11,使Zn2+沉淀完全
【解析】
利用废旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO,电池铜帽加入水过滤后除去溶于水的杂质,在固体中加入稀硫酸酸化的过氧化氢溶解,铜生成硫酸铜溶液,加入氢氧化钠溶液调节溶液pH=2沉淀铁离子,加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物),反应过滤得到海绵铜,沉淀锌离子得到氢氧化锌,热分解得到到氧化锌,据此判断。
(1)双氧水在酸性溶液中氧化铜转化成硫酸铜,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O;
(2)①由于碘遇淀粉显蓝色,可淀粉溶液为指示剂,则当最后一滴Na2S2O3溶液滴入时,溶液蓝色变为无色,且30s内不恢复,说明滴定到达终点,故答案为:淀粉溶液;滴入最后一滴标准溶液,溶液由蓝色变为无色,且30s内不恢复;
②②根据题中数据可知,第一次数据偏差较大,为偶然误差,应去掉,所以Na2S2O3标准溶液的体积为![]() mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531mol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量为0.002531mol×
mL=25.31mL,则消耗的Na2S2O3的物质的量为0.1000mol/L×0.02531L=0.002531mol,根据反应2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-得关系式2Cu2+~I2~2S2O32-,根据关系可求得铜元素的质量为0.002531mol×![]() ×64g/mol=0.8099g,所以铜的质量分数为
×64g/mol=0.8099g,所以铜的质量分数为![]() ×100%=80.99%;若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2生成的碘,使测定结果偏高,故答案为:80.99%;偏高;
×100%=80.99%;若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2生成的碘,使测定结果偏高,故答案为:80.99%;偏高;
(3)50mL 0.0001 mol·L-1CuSO4溶液与50mL0.00022 mol·L-1NaOH混合后n(Cu2+)=50 ×10-3L×0.0001 mol·L-1=5×10-6 mol,n(OH-) =50 ×10-3L×0.00022 mol·L-1=1.1×10-5 mol,则CuSO4溶液与NaOH溶液按1:2生成Cu (OH)2后氢氧根离子过量,过量的c(OH-)=![]() =1×10-5 mol/L,故溶液的pH=
=1×10-5 mol/L,故溶液的pH=![]() =9;
=9;
(4)除去铜的滤液中含有Fe3+、Fe2+、Zn2+等,若制备ZnO应除去Fe3+和Fe2+。由表中信息可知,Fe2+和Zn2+开始沉淀和沉淀完全的pH均相差较小,但Fe3+与Zn2+开始沉淀和沉淀完全的pH均相差较大,故可加入30%H2O2将Fe2+氧化成Fe3+,再滴加NaOH溶液,调节溶液的pH(3.2≤pH<5.9),使Fe3+沉淀完全,此时Zn2+不产生沉淀,充分反应后过滤,向滤液中滴加NaOH溶液,调节溶液的pH(8.9≤pH≤11),使Zn2+产生Zn(OH)2沉淀,并对Zn(OH)2沉淀进行洗涤、干燥、煅烧,即可得到ZnO,故答案为:滴加1.0 mol·L-1NaOH,调溶液pH为3.2≤pH<5.9,使Fe3+沉淀完全;向滤液中滴加1. 0 mol·L-1NaOH,调节溶液pH 为8. 9≤pH≤11,使Zn2+沉淀完全。


科目:高中化学 来源: 题型:
【题目】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__%(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
时间/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
则鼓风炉中CO总的转化率为___;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P) ____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应a A(g)+b B(s)![]() c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
c C(g)+d D(g)达平衡后,保持温度不变,将容器缩小为原来的一半,达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是
A. 平衡向逆反应方向移动B. a<c+d
C. 物质A的转化率增大D. 物质D的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TK时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
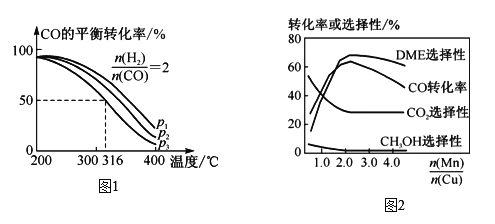
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧硫酸氢钾复合盐(K2SO4KHSO42KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
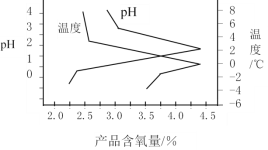
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI
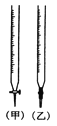
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
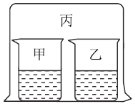
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第4周期的A、B、C、D四种元素,其最外层电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A和B的次外层电子数均为8,而C与D的次外层电子数均为18,根据结构用元素符号或化学式填空:
(1)写出元素名称:A____、B_____、C _____、D ____。
(2)D的简单离子的电子排布式_______________。
(3)元素的氢氧化物碱性最强的是______________。
(4)B原子与D原子间形成化合物的电子式为____________。
(5)写出A、B的第一电离能大小____________________。
(6)写出C基态原子的外围电子排布图______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A的分子式为C6H12,分子中含有碳碳双键,且仅有一种类型的氢原子,在下面的转化关系中,D1、D2互为同分异构体,E1、E2互为同分异构体。
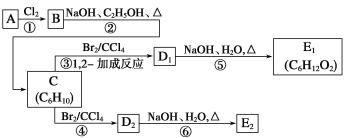
(1)反应②的化学方程式为
___________________________________________________________;
(2)C的化学名称是_____________________________;E2的结构简式是_______________________;
(3)④、⑥的反应类型依次是_________________________、__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com