
【题目】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__%(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
时间/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
则鼓风炉中CO总的转化率为___;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P) ____?
【答案】48.5% 50.0 14.3% 90.9% 12.6 g 459.2 L
【解析】
(1)ZnS中锌的质量分数ω(S)=![]() ,则:ω(ZnS)×
,则:ω(ZnS)×![]() =16%,故ω(ZnS)=48.5%,设生成98%硫酸为x t,则: S~~~~~~~H2SO4
=16%,故ω(ZnS)=48.5%,设生成98%硫酸为x t,则: S~~~~~~~H2SO4
32 98
100 t×16% x t×98%
所以32:98=(100t×16%):(x t×98%),解得x=50,
故答案为:48.5%;50.0;
(2)假定有2 mol ZnS,最少通入3 mol O2,根据方程式2ZnS(s)+3O2=2ZnO(s)+2SO2(g) 可知,生成的SO2的物质的量为2mol,未参加反应的N2的物质的量为3mol×4=12mol,此时SO2的体积分数为![]() ×100%=14.3%.实际通入的空气要多,故SO2的体积分数不超过14.3%,
×100%=14.3%.实际通入的空气要多,故SO2的体积分数不超过14.3%,
故答案为:14.3;
(3)由表可知,3min时反应达平衡,平衡时时CO的平衡浓度为0.01mol/L,所以CO的总转化率为![]() ×100%=90.9%,令需焦炭质量为m g,实际利用的为95%m g,由方程式可得,关系式ZnO(s)~C(s),所以n(ZnO)=n(C),即
×100%=90.9%,令需焦炭质量为m g,实际利用的为95%m g,由方程式可得,关系式ZnO(s)~C(s),所以n(ZnO)=n(C),即![]() =1,解得m=12.6;
=1,解得m=12.6;
故答案为:90.9%;12.6g;
(4)设焙烧炉中消耗空气的物质的量为5x,鼓风炉中消耗空气物质的量为5y,
则:2C+O2===2CO; ZnO(s)+CO(g)====Zn(g)+CO2(g);
y 2y 2y×62.5% 1mol
所以2y×62.5%=1mol,解得 y=0.8mol,所以 5y=4mol
2ZnS+3O2=2ZnO+2SO2 △n
2mol 1mol
1mol 0.5mol
所以4x÷(5x-0.5mol)=82.5%,解得 x=3.3mol,所以 5x=16.5mol,则5x+5y=4mol+16.5mol=20.5mol,V(空气)=20.5 mol×22.4 Lmol-1=459.2L;
答案:应向焙烧炉和鼓风炉中鼓入新鲜空气共459.2 L。


科目:高中化学 来源: 题型:
【题目】有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
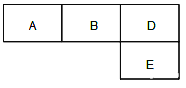
A. 沸点:M2D > BM3 > AM4 B. 原子半径:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 D. B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )
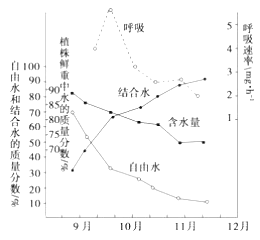
A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
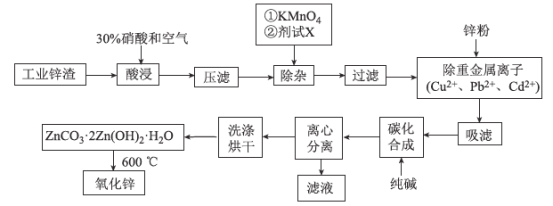
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
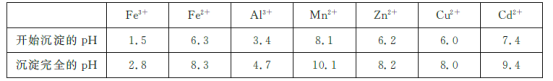
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)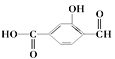 具有官能团分别为:羧基、_______和________(填名称),
具有官能团分别为:羧基、_______和________(填名称),
(2)苯酚与溴水生成白色沉淀,发生__________反应;乙烯通入溴水,发生_______反应。(填“加成”或者“取代”)
(3)以下几组:①白磷和红磷 ②D和T
③异丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互为同系物的是____________;互为同分异构体的是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列6种符号回答问题:①1H ②2H ③3H ④14C ⑤14N ⑥16O
(1)共有________种核素,属于________种元素。
(2)互为同位素的是___________。(填序号,下同)
(3)中子数相等的是________________。
Ⅱ.有下列物质:①CO2 ②KCl ③氮气 ④H2⑤NH4Cl ⑥NaOH ⑦H2SO4试用以上编号填空:
(1)只有非极性键的是______________;
(2)只有极性键的是__________________;
(3)只有离子键的是___________________;
(4)既有离子键,又有极性键的是___________________;
(5)属于共价化合物的是___________________。
Ⅲ.写出下列物质的电子式
(1)N2__________;HClO_________;MgCl2___________;NaOH___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
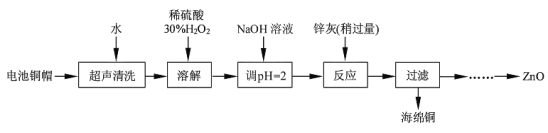
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式____;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为____,滴定终点观察到的现象为___;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为____(结果保留四位有效数字),若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会____(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。计算沉淀生成的溶液的pH= ___(假设Cu2+被完全沉淀,混合后溶液体积不发生变化);
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入适量30% H2O2,使其充分反应;
②_______;
③过滤;
④______;
⑤过滤、洗涤、干燥;
⑥900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com