
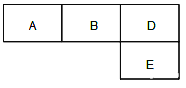
【题目】有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
A. 沸点:M2D > BM3 > AM4 B. 原子半径:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 D. B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
【答案】D
【解析】M元素的单质是自然界最轻的气体,M为H;N元素的原子半径是所在周期原子半径最大的,则N应为第三周期第ⅠA族的Na;结合图中的位置,设A的原子序数为x,则B为x+1,c为x+2,E为x+10,它们的原子序数之和为37,所以x+x+1+x+2+x+10=37,x=6,即A为C,B为N、D为O,E为S;A.C、N、O三种元素分别与H元素形成的简单化合物中,NH3、H2O的分子中含有氢键,但H2O的沸点最大,沸点的大小顺序为:H2O>NH3>CH4,故A正确;B.同周期主族元素随核电荷数增大,原子半径减小,同族核电荷数大,原子半径大,则原子半径:S>C>N>O,故B正确;C.化合物CnH2n分子内含有碳氢键为极性间,碳与碳之间的单键或双键均为非极性键,故C正确;D.氨气在纯氧中燃烧,生成N2和H2O,该反应为4NH3+3O2![]() 2N2+6H2O,N元素的化合价升高,O元素的化合价降低,则氧气为氧化剂、氨气为还原剂,所以该反应中氧化剂与还原剂的物质的量之比为3︰4,故D错误;答案为D。
2N2+6H2O,N元素的化合价升高,O元素的化合价降低,则氧气为氧化剂、氨气为还原剂,所以该反应中氧化剂与还原剂的物质的量之比为3︰4,故D错误;答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
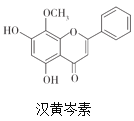
A. 能与Na2CO3溶液反应放出气体
B. 该物质遇FeCl3溶液不显色
C. 1mol该物质与溴水反应,最多消耗2molBr2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B.将温度计水银球插入自来水中
C.冷水从冷凝管下口入,上口出
D.收集蒸馏水时,应弃去开始馏出的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的CO与CO2之间:二者的质量之比为______,所含氧原子数之比为______。
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则混合气体中CO的体积为______, CO2的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。工业上,通过如下转化可制得KClO3晶体:![]()
(1) 与氯元素同族的短周期元素的原子核外电子排布式为______________________。
(2)上述转化过程中所涉及的短周期元素中,原子半径由大到小的顺序是______________。
(3)硫与氯同周期,写出一个能比较硫和氯非金属性强弱的化学反应方程式____________。硫单质不溶于水,易溶于CS2,则CS2分子的结构式为___________。
(4)电解氯化钠溶液可以得到NaClO3与H2。写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________________。
(5) II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体。该反应能够发生的原因是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),形成沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法不正确的是

A. 若向沉淀剂Na2S溶液通入HC1气体至中性,存在关系: c(HS-)+2c(H2S)=c(Cl-)
B. 该温度下,Ksp(MnS)大于1.0×10-35
C. 若将MnS、FeS的饱和溶液等体积混合,再加入足量的浓 Na2S溶液,发生的反应为MnS沉淀少于FeS
D. 向l00mL浓度均为10-5mol·L-1Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol·L-1Na2S溶液,ZnS先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__%(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
时间/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
则鼓风炉中CO总的转化率为___;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P) ____?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com