
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。工业上,通过如下转化可制得KClO3晶体:![]()
(1) 与氯元素同族的短周期元素的原子核外电子排布式为______________________。
(2)上述转化过程中所涉及的短周期元素中,原子半径由大到小的顺序是______________。
(3)硫与氯同周期,写出一个能比较硫和氯非金属性强弱的化学反应方程式____________。硫单质不溶于水,易溶于CS2,则CS2分子的结构式为___________。
(4)电解氯化钠溶液可以得到NaClO3与H2。写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________________。
(5) II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体。该反应能够发生的原因是__________________________________________________________________。
【答案】1s22s22p5 Na>Cl>O (Na>Cl>O >H亦可) H2S+Cl2→S+2HCl S=C=S ![]() 室温下,氯酸钾在水中的溶解度明显小于其他晶体
室温下,氯酸钾在水中的溶解度明显小于其他晶体
【解析】
(1)与氯元素同族的短周期元素为F,原子序数为9,核外电子数为9;
(2)上述转化过程中所涉及的短周期元素有O、Cl、Na,电子层越多,原子半径越大,同周期从左向右原子半径减小;
(3)利用单质之间的置换反应比较非金属性;CS2分子与CO2分子结构相似;
(4)电解氯化钠溶液可以得到NaClO3与H2,由电子、原子守恒可知反应为NaCl+3H2O![]() NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-;
NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-;
(5)发生复分解反应,析出KClO3晶体,与其溶解度小有关。
(1)与氯元素同族的短周期元素为F,原子序数为9,核外电子数为9,则核外电子排布式为1s22s22p5;
(2)上述转化过程中所涉及的短周期元素有O、Cl、Na,电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径由大到小的顺序是Na>Cl>O;
(3)利用单质之间的置换反应比较非金属性,能比较硫和氯非金属性强弱的化学反应方程式如H2S+Cl2=S+2HCl;CS2分子与CO2分子结构相似,CS2分子的结构式为S=C=S;
(4)电解氯化钠溶液可以得到NaClO3与H2,由电子、原子守恒可知反应为NaCl+3H2O![]() NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-,反应及电子转移的方向和数目为
NaClO3+3H2↑,该反应中Cl失去电子,H得到电子,共转移6e-,反应及电子转移的方向和数目为![]() ;
;
(5)II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体.该反应能够发生的原因是室温下,氯酸钾在水中的溶解度明显小于其他晶体。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
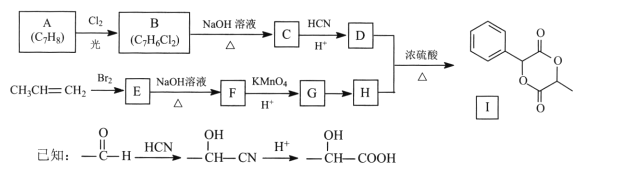
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入0.05mol·L-1盐酸0.125VL
C.加入10mol·L-1盐酸0.1VL,再稀释至1.5VL
D.标准状况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
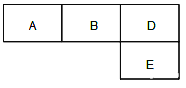
A. 沸点:M2D > BM3 > AM4 B. 原子半径:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 D. B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。

(1)甲中含氧官能团是__________(填名称)。
(2)下列关于乙的说法正确的是________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________。
a.含有![]()
b.在稀硫酸中水解有乙酸生成
(4)写出丁在氢氧化钠溶液中水解的化学方程式。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料。
(1)等物质的量浓度的两溶液,pH大小为:氯化铵___________硫酸铵(选填>、=或<,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵___________硫酸铵;
(2)检验铵态氮肥中铵根离子的实验方案是______________________________________;
(3) 长期施用硫酸铵,土壤会酸化板结的原因是__________________________________。
II.最新“人工固氮”的研究报道:常温常压、催化剂条件下,N2与水发生反应:2N2 (g)+6H2O(l)![]() 4NH3 (g)+3O2 (g) Q,(Q﹥0)。
4NH3 (g)+3O2 (g) Q,(Q﹥0)。
(4)如果反应的平衡常数K值变小,该反应正反应速率__________(选填增大、减小或不变,下同),逆反应速率__________。
(5)请用上述反应中的有关物理量来说明该反应已达到平衡状态______________________。
(6)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: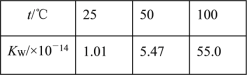
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)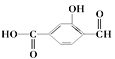 具有官能团分别为:羧基、_______和________(填名称),
具有官能团分别为:羧基、_______和________(填名称),
(2)苯酚与溴水生成白色沉淀,发生__________反应;乙烯通入溴水,发生_______反应。(填“加成”或者“取代”)
(3)以下几组:①白磷和红磷 ②D和T
③异丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互为同系物的是____________;互为同分异构体的是_______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com