
【题目】I.工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料。
(1)等物质的量浓度的两溶液,pH大小为:氯化铵___________硫酸铵(选填>、=或<,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵___________硫酸铵;
(2)检验铵态氮肥中铵根离子的实验方案是______________________________________;
(3) 长期施用硫酸铵,土壤会酸化板结的原因是__________________________________。
II.最新“人工固氮”的研究报道:常温常压、催化剂条件下,N2与水发生反应:2N2 (g)+6H2O(l)![]() 4NH3 (g)+3O2 (g) Q,(Q﹥0)。
4NH3 (g)+3O2 (g) Q,(Q﹥0)。
(4)如果反应的平衡常数K值变小,该反应正反应速率__________(选填增大、减小或不变,下同),逆反应速率__________。
(5)请用上述反应中的有关物理量来说明该反应已达到平衡状态______________________。
(6)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为______________________。
【答案】〉 〉 取样,加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,则含有铵根离子;反之没有 硫酸铵是强酸弱碱盐,其溶液呈酸性,所以长期施用,土壤会酸化板结 减小 减小 容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3(合理即可) 0.00125 mol·L-1min-1
【解析】
(1)等物质的量浓度的氯化铵和硫酸铵,硫酸铵中的铵根离子浓度大,溶液PH小,若铵根离子浓度相同则硫酸铵溶液浓度小;
(2)依据铵根离子和氢氧根离子结合生成一水合氨,加热分解生成的氨气能使湿润的红色石蕊试纸变蓝设计证明;
(3)长期施用硫酸铵能够使土壤中的氢离子浓度升高;
(4)2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,温度降低,反应速率减小;
4NH3(g)+3O2(g)Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,温度降低,反应速率减小;
(5)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变分析,由此分析解答;
(6)容器内气体的密度增大了0.18g/L,即水的质量减少了0.18g/L×2L=0.36g,则生成氧气物质的量为:![]() ×
×![]() =0.01mol,再据v=
=0.01mol,再据v=![]() 计算速率。
计算速率。
(1)等物质的量浓度的两溶液,氯化铵含一个铵根,硫酸铵含两个铵根,pH大小为:氯化铵>硫酸铵,铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵>硫酸铵;
(2)检验铵态氮肥中铵根离子的实验方案是:取样,加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,则含有铵根离子;反之没有;
(3)长期施用硫酸铵会使土壤板结酸化,硫酸铵是强酸弱碱盐,其溶液呈酸性,所以长期施用,土壤会酸化板结;
(4)2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,应降低温度,温度降低,反应速率减小,正反应速率和逆反应速率都减小;
4NH3(g)+3O2(g)Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,应降低温度,温度降低,反应速率减小,正反应速率和逆反应速率都减小;
(5)2N2(g)+6H2O(l)![]() 4NH3 (g)+3O2(g)Q,(Q>0),反应是有液体参加的气体体积增大的吸热反应,容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3时,都可以说明反应达到平衡状态;
4NH3 (g)+3O2(g)Q,(Q>0),反应是有液体参加的气体体积增大的吸热反应,容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3时,都可以说明反应达到平衡状态;
(6)容器内气体的密度增大了0.18g/L,即水的质量减少了0.18g/L×2L=0.36g,则生成氧气物质的量为:![]() ×
×![]() =0.01mol,据v(O2)=
=0.01mol,据v(O2)=![]() =
= =0.00125 molL-1min-1。
=0.00125 molL-1min-1。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写不正确的是
A. 用FeCl3溶液腐蚀印刷线路板上的Cu:2Fe3++Cu=2Fe2++Cu2+
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 稀硝酸中加入过量铁粉: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 用Na2CO3溶液浸泡锅炉水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的CO与CO2之间:二者的质量之比为______,所含氧原子数之比为______。
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则混合气体中CO的体积为______, CO2的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。工业上,通过如下转化可制得KClO3晶体:![]()
(1) 与氯元素同族的短周期元素的原子核外电子排布式为______________________。
(2)上述转化过程中所涉及的短周期元素中,原子半径由大到小的顺序是______________。
(3)硫与氯同周期,写出一个能比较硫和氯非金属性强弱的化学反应方程式____________。硫单质不溶于水,易溶于CS2,则CS2分子的结构式为___________。
(4)电解氯化钠溶液可以得到NaClO3与H2。写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________________。
(5) II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体。该反应能够发生的原因是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】YBa2Cu3Ox(Y为元素钇)是一种重要超导材料,下列关于![]() 的说法错误的是( )
的说法错误的是( )
A.质量数是89B.质子数与中子数之差为50
C.核外电子数是39D.与![]() 互为同位素
互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),形成沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法不正确的是

A. 若向沉淀剂Na2S溶液通入HC1气体至中性,存在关系: c(HS-)+2c(H2S)=c(Cl-)
B. 该温度下,Ksp(MnS)大于1.0×10-35
C. 若将MnS、FeS的饱和溶液等体积混合,再加入足量的浓 Na2S溶液,发生的反应为MnS沉淀少于FeS
D. 向l00mL浓度均为10-5mol·L-1Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol·L-1Na2S溶液,ZnS先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸生产中炉气转化反应为:2SO2(g)+O2(g)![]() 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是
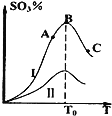
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)= v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5作催化剂的曲线,则Ⅱ可表示为Fe2O3作催化剂的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求写出化学方程式
(1)乙烯发生聚合反应:_____________________________________________
(2)苯与浓硝酸反应:_____________________________________________
(3)乙醇和乙酸的酯化反应:___________________________________________
(4)乙醇消去反应制乙烯:______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com