
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入0.05mol·L-1盐酸0.125VL
C.加入10mol·L-1盐酸0.1VL,再稀释至1.5VL
D.标准状况下通入11.2L氯化氢气体
【答案】C
【解析】
A.盐酸具有挥发性,加热浓缩时挥发的不仅是溶剂水,还有部分溶质HCl,导致所得溶液的浓度比期望值偏小,该方法不适宜,故A错误;
B.向溶液中加入0.05molL-1盐酸0.125VL,会引起溶液体积的变化,导致所得溶液浓度与期望浓度有偏差,故B错误;
C.加入10molL-1盐酸0.1VL,混合液中HCl的物质的量为:10mol/L×0.1VL+0.5mol/L×VL=1.5Vmol,则所得溶液浓度为:![]() =1mol/L,该方法合理,所得溶液浓度为1mol/L,故C正确;
=1mol/L,该方法合理,所得溶液浓度为1mol/L,故C正确;
D.标准状况下通入11.2L氯化氢气体,会导致溶液体积发生变化,则所得溶液浓度会发生变化,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的数据如下表所示:

实验编号 | 水果种类 | 电极间距离/cm | 电流大小/μA |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)上图所示的装置中,做负极的材料是______(填“锌片”或“铜片”),该装置给将_________转变为电能。
(3)能表明水果种类对电流大小有影响的实验编号是____和_______。
(4)请你再提一个可能影响水果电池电流大小的因素:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
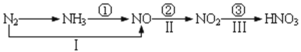
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线ⅠⅡ Ⅲ是雷电固氮生成硝酸的主要途径
C.氮气可在足量的氧气中通过一步反应生成NO2
D.上述所有反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B.将温度计水银球插入自来水中
C.冷水从冷凝管下口入,上口出
D.收集蒸馏水时,应弃去开始馏出的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
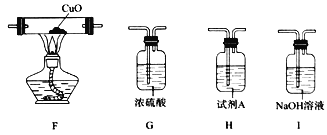
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的CO与CO2之间:二者的质量之比为______,所含氧原子数之比为______。
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则混合气体中CO的体积为______, CO2的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。工业上,通过如下转化可制得KClO3晶体:![]()
(1) 与氯元素同族的短周期元素的原子核外电子排布式为______________________。
(2)上述转化过程中所涉及的短周期元素中,原子半径由大到小的顺序是______________。
(3)硫与氯同周期,写出一个能比较硫和氯非金属性强弱的化学反应方程式____________。硫单质不溶于水,易溶于CS2,则CS2分子的结构式为___________。
(4)电解氯化钠溶液可以得到NaClO3与H2。写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________________。
(5) II中不断加入细粒状KCl,搅拌,发生复分解反应,析出KClO3晶体。该反应能够发生的原因是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量锌与 100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体 0.8mol, 将反应后的溶液稀释得 40mL,测得溶液 c(H+)=2mol/L,则下列叙述中错误的是
A. 气体中 SO2 和 H2 物质的量比为 6:1B. 反应中共消耗锌 52.0g
C. 所得气体应该为 SO2 和 H2 混合物D. 反应共转移电子 1.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com