
【题目】将一定量锌与 100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体 0.8mol, 将反应后的溶液稀释得 40mL,测得溶液 c(H+)=2mol/L,则下列叙述中错误的是
A. 气体中 SO2 和 H2 物质的量比为 6:1B. 反应中共消耗锌 52.0g
C. 所得气体应该为 SO2 和 H2 混合物D. 反应共转移电子 1.6mol
【答案】A
【解析】
Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算。
生成气体的物质的量为0.8mol,溶液剩余硫酸的物质的量为![]() ×0.4L×2mol/L=0.4mol,参加反应的n(H2SO4)=0.1L×18mol/L-0.4mol=1.4mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
×0.4L×2mol/L=0.4mol,参加反应的n(H2SO4)=0.1L×18mol/L-0.4mol=1.4mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2xx
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=0.8、2x+y=1.4,解之得 x=0.6,y=0.2,所以反应会生成0.6mol的二氧化硫和0.2mol的氢气;
A.气体中SO2和H2物质的量比为3:1,故A错误;
B.生成1mol混合气体转移2mol电子,消耗1mol的锌,所以反应中共消耗金属Zn的质量m(Zn)=0.8×65g/mol=52g,故B正确;
C.由以上分析可知气体A为SO2和H2的混合物,故C正确;
D.生成1mol混合气体转移2mol电子,所以反应共转移电子1.6mol,故D正确;故答案为A。


科目:高中化学 来源: 题型:
【题目】现有VL浓度为0.5mol·L-1的盐酸,现欲将此盐酸浓度增大1倍,以下方法最宜采用的是( )
A.加热浓缩到溶液体积为![]() L
L
B.加入0.05mol·L-1盐酸0.125VL
C.加入10mol·L-1盐酸0.1VL,再稀释至1.5VL
D.标准状况下通入11.2L氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 热纯碱溶液比冷的纯碱溶液洗涤油污的能力强
B. 向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
C. 水的离子积随温度变化如表格所示: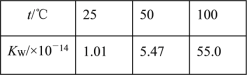
D. 对CO(g)+NO2(g) ![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是
A. NH4+为正四面体形B. SO2 为直线形
C. HCN 为平面三角形D. BF3 为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )
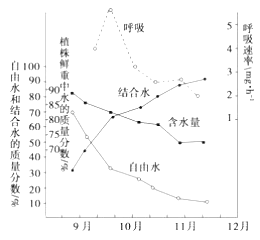
A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)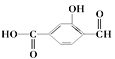 具有官能团分别为:羧基、_______和________(填名称),
具有官能团分别为:羧基、_______和________(填名称),
(2)苯酚与溴水生成白色沉淀,发生__________反应;乙烯通入溴水,发生_______反应。(填“加成”或者“取代”)
(3)以下几组:①白磷和红磷 ②D和T
③异丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互为同系物的是____________;互为同分异构体的是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2 析出,依据I2 析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝的时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
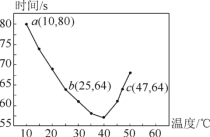
A. 40℃之前与40℃之后溶液变蓝时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3的平均反应速率一定相等
C. 图中a点对应的NaHSO3的平均反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com