
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是
A. NH4+为正四面体形B. SO2 为直线形
C. HCN 为平面三角形D. BF3 为三角锥形
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
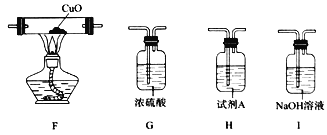
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:
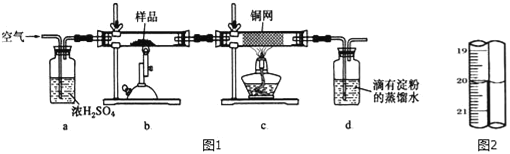
称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.01mL,末读数如图2所示.
完成下列填空:
(1)实验中称量样品所需定量仪器为_____.
(2)装置c的作用是_____.
(3)上述反应结束后,仍需通一段时间的空气,其目的是_____.
(4)滴定时,标准碘溶液所耗体积为_____mL.用化学方程式表示滴定的原理:_____.
(5)计算该黄铜矿的纯度_____.
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.选用提供的试剂,设计实验验证炉渣中含有FeO.提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液,所选试剂为_____.证明炉渣中含有FeO的实验现象为:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知二茂铁(Fe(C5H5)2)熔点是173 ℃(在100 ℃时开始升华),沸点是249℃,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,C5H5 -与Fe2+之间是以离子键相结合
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
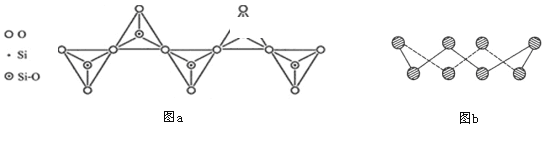
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为
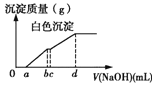
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量锌与 100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体 0.8mol, 将反应后的溶液稀释得 40mL,测得溶液 c(H+)=2mol/L,则下列叙述中错误的是
A. 气体中 SO2 和 H2 物质的量比为 6:1B. 反应中共消耗锌 52.0g
C. 所得气体应该为 SO2 和 H2 混合物D. 反应共转移电子 1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。
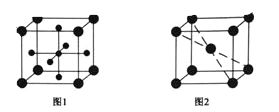
(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为: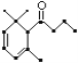 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A. 分子式为C13H20O
B. 1mo该化合物可与3molH2发生加成反应
C. 1mol该化合物完全燃烧消耗18 mol O2
D. 1mol该化合物最多与2mol溴单质加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:![]()
![]()
![]()
(1)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是_____。
A. 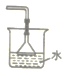 B.
B. 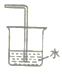 C.
C. 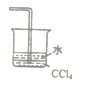 D.
D. 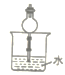
(2)某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。写出该反应的平衡常数表达式_______。若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是_____(填字母代号)。
A. 压缩容器体积 B. 适当升高温度 C. 通入适量氮气 D. 加适量催化剂
(3)能说明上述反应达到平衡状态的是____________
A. ![]() B. 混合气体的密度不再改变
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变 D. 单位时间内生成n mol N2 的同时生成2n mol NH3
(4)氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),
![]() 的电离程度______,溶液的pH值_____。
的电离程度______,溶液的pH值_____。
氨气与酸反应得到铵盐,某![]() 水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com