
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。
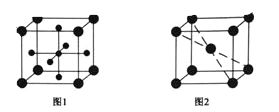
(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
【答案】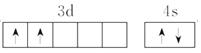 > > N的价电子排布式为2s22p3,O为2s22p4,N为半满结构较稳定,第一电离能大于O 正四面体 sp3 PO43-、ClO4-等 12
> > N的价电子排布式为2s22p3,O为2s22p4,N为半满结构较稳定,第一电离能大于O 正四面体 sp3 PO43-、ClO4-等 12 ![]() ×100%
×100%
【解析】
(1)Ti是22号元素,处于周期表中第四周期IVB族,价电子排布式为3d24s2,结合泡利原理、洪特规则画出价电子排布图;
(2)同周期主族元素随原子序数增大电负性增大;N原子中的2p轨道处于半充满状态,第一电离能高于同周期相邻元素的;
(3)SO42-中S原子孤电子对数=![]() =0,价层电子对数=4=0=4;与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷;
=0,价层电子对数=4=0=4;与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷;
(4)Ti4+位于立方体的顶点,晶胞中Ti4+原子数目为1、体心黑色球数目为1、面心黑色球数目为3,故体心为Ca2+、面心为O2-,与Ti4+紧密相邻的O2-处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
(5)处于体对角线上Fe原子相邻,晶胞体对角线长度等于晶胞棱长的![]() 倍,而晶胞体对角线长度=4倍的Fe原子半径,均摊法计算晶胞中Fe原子数目,计算晶胞中原子总体积,晶胞的空间利用率=(原子总体积÷晶胞体积)×100%。
倍,而晶胞体对角线长度=4倍的Fe原子半径,均摊法计算晶胞中Fe原子数目,计算晶胞中原子总体积,晶胞的空间利用率=(原子总体积÷晶胞体积)×100%。
(1)Ti是22号元素,处于周期表中第四周期IVB族,价电子排布式为3d24s2,由泡利原理、洪特规则,价电子排布图为: ;
;
(2)同周期主族元素随原子序数增大电负性增大,故电负性C>B;N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的,故第一电离能:N>O;
(3)SO42-中S原子孤电子对数=![]() =0,价层电子对数=4=0=4,空间构型为正四面体形,S原子采取sp3杂化,与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷,即SO42-的一种等电子体的化学式:PO43-、ClO4-等;
=0,价层电子对数=4=0=4,空间构型为正四面体形,S原子采取sp3杂化,与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷,即SO42-的一种等电子体的化学式:PO43-、ClO4-等;
(4)Ti4+位于立方体的顶点,晶胞中Ti4+原子数目为1、体心黑色球数目为1、面心黑色球数目为3,故体心为Ca2+、面心为O2-,与Ti4+紧密相邻的O2-处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,即与Ti4+紧密相邻的O2-数目=![]() =12;
=12;
(5)处于体对角线上Fe原子相邻,晶胞体对角线长度等于晶胞棱长的![]() 倍,而晶胞体对角线长度=4倍的Fe原子半径,故4r=
倍,而晶胞体对角线长度=4倍的Fe原子半径,故4r=![]() a,则r=
a,则r=![]() a,晶胞中Fe原子数目=1+8×
a,晶胞中Fe原子数目=1+8×![]() =2,晶胞中原子总体积=2×
=2,晶胞中原子总体积=2×![]() πr3,晶胞的空间利用率=(2×
πr3,晶胞的空间利用率=(2×![]() πr3÷a3)×100%=[(2×
πr3÷a3)×100%=[(2××π×(
![]() a)3÷a3]×100%=
a)3÷a3]×100%=![]() ×100%。
×100%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是
A. NH4+为正四面体形B. SO2 为直线形
C. HCN 为平面三角形D. BF3 为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
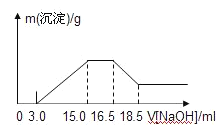
下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )
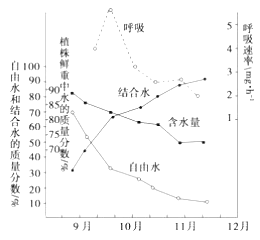
A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
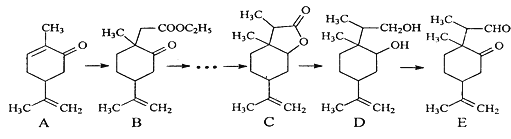
已知:①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
②RCH2COOR' ![]() RCH(CH3)COOR',RCOR'
RCH(CH3)COOR',RCOR' ![]() RCH(OH)R',RCOOR'
RCH(OH)R',RCOOR' ![]() RCH2OH+R'OH。
RCH2OH+R'OH。
(1)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为_____。
(2)C用LiBH4还原得到D,C→D不直接用镍作催化剂H2还原的原因是______。
(3)写出一种满足下列条件的A的同分异构体的结构简式为_____________。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
(4)写出E和银氨溶液反应的化学方程式_________。
(5)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选),合成路线常用的表示方式为:![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
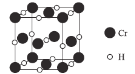
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com