
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
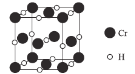
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
【答案】3d54s1 +6 > 2CrCl3+H2![]() 2CrCl3+2HCl 离子 sp2、sp3
2CrCl3+2HCl 离子 sp2、sp3 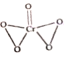 Cr4H4(或CrH)
Cr4H4(或CrH) ![]()
【解析】
(1)根据基态铬原子得核外电子排布,写出价电子排布式;根据价层电子,确定铬元素的最高价态;价电子处于半满或全满时比较稳定,电离能比较大;
(2)CrCl3在含HCl的H2气流中被还原,写出方程式;离子晶体的熔点较高;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
(3)CrO3中铬元素为+6价,则存在2个过氧根,确定结构式;
(4)均摊法确定化学式。确定一个晶胞的质量和体积,在计算晶胞密度;
(1)基态铬原子的价电子排布式为3d54s1;根据价层电子,铬元素的最高价态为+6。基态Cr+的价电子排布式为3d5、基态Mn+的加点字排布式为3d54s1,故铬元素的第二电离能大于锰元素的第二电离能;
答案:3d54s1 +6 >
(2)CrCl3在含HCl的H2气流中被还原,反应方程式为2CrCl3+H2![]() 2CrCl3+2HCl;CrCl3的熔点较高,为离子晶体;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
2CrCl3+2HCl;CrCl3的熔点较高,为离子晶体;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
答案:2CrCl3+H2![]() 2CrCl3+2HCl 离子 sp2、sp3
2CrCl3+2HCl 离子 sp2、sp3
(3)CrO3中铬元素为+6价,则存在2个过氧根,结构式为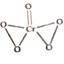 ;
;
答案:
(4)每个晶胞中的Cr原子数为8×1/8+6×1/2=4,H原子数为12×1/4+1=4,故其化学式为Cr4H4(也可以简化为CrH,但不可简化为Cr2H2)。一个晶胞的质量为![]() g,一个晶胞的体积为(4.376×10-8)3cm3,则晶体的密度为
g,一个晶胞的体积为(4.376×10-8)3cm3,则晶体的密度为![]() ;
;
答案:![]()


科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:
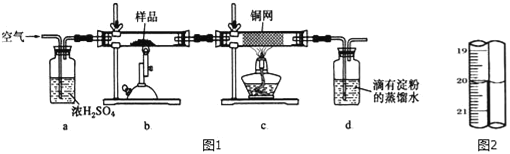
称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.01mL,末读数如图2所示.
完成下列填空:
(1)实验中称量样品所需定量仪器为_____.
(2)装置c的作用是_____.
(3)上述反应结束后,仍需通一段时间的空气,其目的是_____.
(4)滴定时,标准碘溶液所耗体积为_____mL.用化学方程式表示滴定的原理:_____.
(5)计算该黄铜矿的纯度_____.
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.选用提供的试剂,设计实验验证炉渣中含有FeO.提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液,所选试剂为_____.证明炉渣中含有FeO的实验现象为:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。
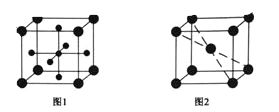
(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为: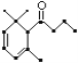 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A. 分子式为C13H20O
B. 1mo该化合物可与3molH2发生加成反应
C. 1mol该化合物完全燃烧消耗18 mol O2
D. 1mol该化合物最多与2mol溴单质加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-十Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是
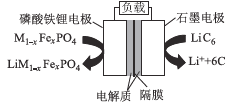
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
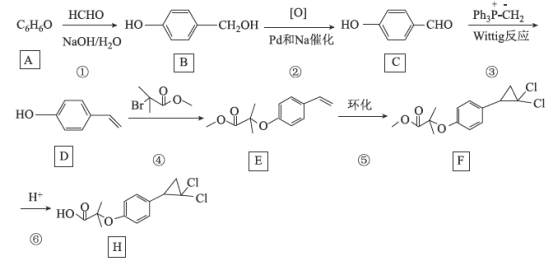
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH 溶液反应测定中和热。下图装置不妥之处是_______,应如何改正____________,NaOH的量要比HCl多一些的原因是____________。
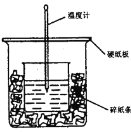
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:![]()
![]()
![]()
(1)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是_____。
A. 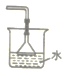 B.
B. 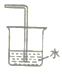 C.
C. 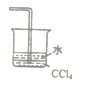 D.
D. 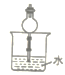
(2)某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。写出该反应的平衡常数表达式_______。若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是_____(填字母代号)。
A. 压缩容器体积 B. 适当升高温度 C. 通入适量氮气 D. 加适量催化剂
(3)能说明上述反应达到平衡状态的是____________
A. ![]() B. 混合气体的密度不再改变
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变 D. 单位时间内生成n mol N2 的同时生成2n mol NH3
(4)氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),
![]() 的电离程度______,溶液的pH值_____。
的电离程度______,溶液的pH值_____。
氨气与酸反应得到铵盐,某![]() 水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
水溶液的pH=5,原因是溶液中存在平衡_____(用离子方程式表示),该稀溶液中水的电离度约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为某原子3d能级的电子排布情况.
![]()
该排布情况违反了________原理
(2)s电子的原子轨道呈_________形,每个s能级有_________个原子轨道;p电子的原子轨道_________形,每个p能级有_________个原子轨道。
(3)填表
分子或离子 | CO2 | H2O | SO3 | NH4+ | N2O |
VSEPR模型名称 | ____ | _____ | ____ | ____ | _____ |
中心原子杂化轨道类型 | ____ | ____ | ____ | ____ | ____ |
分子或离子立体构型 | ___ | ___ | ___ | ___ | ___ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com