
【题目】用50mL 0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH 溶液反应测定中和热。下图装置不妥之处是_______,应如何改正____________,NaOH的量要比HCl多一些的原因是____________。
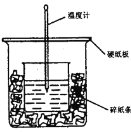
【答案】无环形玻璃搅拌棒、硬纸板; 增加环形玻璃搅拌棒、把硬纸板换成泡沫塑料板; 使HCl尽可能与NaOH反应而避免与![]() 反应,实验数据更准确。
反应,实验数据更准确。
【解析】
测定中和热应在最短时间内让盐酸与氢氧化钠充分反应,所以应增添搅拌装置;为了测得温度的最高值,应加强保温、隔热和防止热量散失。
①装置不妥之处:无环形玻璃搅拌棒、小烧杯口与大烧杯口未相平、硬纸板隔热效果不佳;
②改正措施:增加环形玻璃搅拌棒、在大小烧杯间填满碎纸条使小烧杯口与大烧杯口相平、把硬纸板更换成泡沫塑料板;
③NaOH过量的原因:NaOH中必然混有![]() ,会导致一部分盐酸与
,会导致一部分盐酸与![]() 反应,故测得的中和热不准确,过量的NaOH是为了HCl尽可能与NaOH反应而避免与
反应,故测得的中和热不准确,过量的NaOH是为了HCl尽可能与NaOH反应而避免与![]() 反应,使实验数据更准确。
反应,使实验数据更准确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
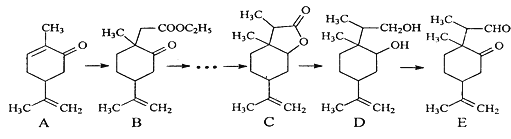
已知:①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
②RCH2COOR' ![]() RCH(CH3)COOR',RCOR'
RCH(CH3)COOR',RCOR' ![]() RCH(OH)R',RCOOR'
RCH(OH)R',RCOOR' ![]() RCH2OH+R'OH。
RCH2OH+R'OH。
(1)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为_____。
(2)C用LiBH4还原得到D,C→D不直接用镍作催化剂H2还原的原因是______。
(3)写出一种满足下列条件的A的同分异构体的结构简式为_____________。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
(4)写出E和银氨溶液反应的化学方程式_________。
(5)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选),合成路线常用的表示方式为:![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
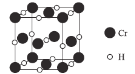
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述正确的是( )
A.H2Y的电离方程式为:![]()
B.在该酸式盐溶液中![]()
C.HY-的水解方程式为![]()
D.在该酸式盐溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com