
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-十Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是
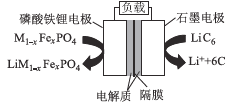
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
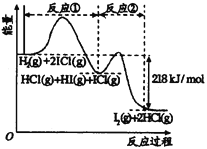
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
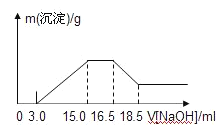
下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种天然药物桥环分子合成的部分路线图(反应条件已经略去):
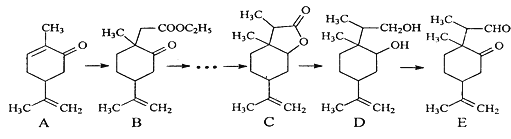
已知:①LiBH4可将醛、酮、酯类还原成醇,但不能还原羧酸、羧酸盐、碳碳双键;LiBH4遇酸易分解。
②RCH2COOR' ![]() RCH(CH3)COOR',RCOR'
RCH(CH3)COOR',RCOR' ![]() RCH(OH)R',RCOOR'
RCH(OH)R',RCOOR' ![]() RCH2OH+R'OH。
RCH2OH+R'OH。
(1)反应A→B中需要加入试剂X,其分子式为C4H8O2,X的结构简式为_____。
(2)C用LiBH4还原得到D,C→D不直接用镍作催化剂H2还原的原因是______。
(3)写出一种满足下列条件的A的同分异构体的结构简式为_____________。①属于芳香族化合物;②能使FeCl3溶液显色;③分子中有4种不同化学环境的氢。
(4)写出E和银氨溶液反应的化学方程式_________。
(5)根据已有知识并结合相关信息,设计B→C的合成路线图(CH3I和无机试剂任选),合成路线常用的表示方式为:![]() 。____________
。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
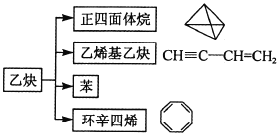
A. 正四面体烷的一氯代物及二氯代物均只有1种
B. 乙炔生成乙烯基乙炔是加成反应
C. ![]() 与环辛四烯(C8H8)互为同分异构体
与环辛四烯(C8H8)互为同分异构体
D. 等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
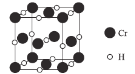
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为___。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为__。
(4)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为____。
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com