
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
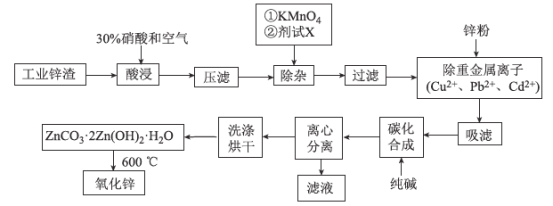
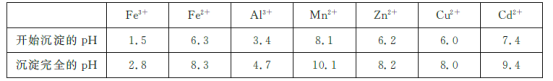
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
【答案】将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等 ZnO[或Zn(OH)2或ZnCO3] 4.7≤pH<6.0 除去Mn2+ 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ Fe(OH)3、Al(OH)3、MnO2 3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3] 静置,取少许上层清液继续滴加纯碱溶液,若无沉淀产生,则证明纯碱过量(或静置,取少许上层清液滴加CaCl2溶液,若有白色沉淀产生,则证明纯碱过量)
【解析】
(1)根据增大固体反应物接触面积,升高温度,增大反应物浓度等角度分析;
(2)根据除杂的同时不要掺入新的杂质考虑;根据流程及表中数据,确定pH的范围;
(3)加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+;
(4)由(2)、(3)知“过滤”所得滤渣;
(5)“碳化合成”时加入Na2CO3,产物为ZnCO3 2Zn(OH)2H2O,写出化学方程式;
(6)若Na2CO3不足,检验溶液中的Zn2+;Na2CO3过量时,可检验溶液中的CO32-;
(1)酸浸的主要目的是将ZnO等物质与硝酸反应,为加快反应速率,可采取的方法有加热、将将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等;
答案:将锌渣粉碎、加热、适当增大硝酸浓度、搅拌等
(2)加入试剂X的目的是调节溶液的pH,使Fe3+、Al3+生成沉淀除去,为不引入新的杂质离子,可加入ZnO、Zn(OH)2、ZnCO3等,根据流程及表中数据,需调节pH的范围为4.7≤pH<6.0;
答案:4.7≤pH<6.0
(3)加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+,反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
答案:除去Mn2+ 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
(4)由(2)、(3)知,“过滤”所得滤渣的主要成分是Fe(OH)3、Al(OH)3、MnO2;
答案:Fe(OH)3、Al(OH)3、MnO2
(5)“碳化合成”时加入Na2CO3,产物为ZnCO3 2Zn(OH)2H2O,反应的化学方程式为3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3];
答案:3Zn(NO3)2+3Na2CO3+3H2O=ZnCO3 2Zn(OH)2H2O↓+2CO2↑+6NaNO3[或3Zn(NO3)2+5Na2CO3+5H2O= ZnCO3 2Zn(OH)2H2O↓+4NaHCO3+6NaNO3]
(6)若Na2CO3不足时,溶液中还有Zn(NO3)2,继续滴加Na2CO3溶液,有沉淀产生;Na2CO3过量时,可检验溶液中的CO32-;
答案:静置,取少许上层清液继续滴加纯碱溶液,若无沉淀产生,则证明纯碱过量(或静置,取少许上层清液滴加CaCl2溶液,若有白色沉淀产生,则证明纯碱过量)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸生产中炉气转化反应为:2SO2(g)+O2(g)![]() 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是
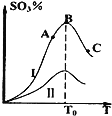
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)= v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5作催化剂的曲线,则Ⅱ可表示为Fe2O3作催化剂的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:_______________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与 100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为______L,转移的电子数____个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体 _____mol。
(3)将标准状况下 6.72L 的 HCl 溶于水形成 250mL 溶液,取出 10mL 于锥形瓶中,溶质的物质的量浓度为_________mol/L,向锥形瓶中滴加 0.5mol/LBa(OH)2 溶液,恰好反应,消耗Ba(OH)2 的体积为______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__%(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
时间/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
则鼓风炉中CO总的转化率为___;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P) ____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求写出化学方程式
(1)乙烯发生聚合反应:_____________________________________________
(2)苯与浓硝酸反应:_____________________________________________
(3)乙醇和乙酸的酯化反应:___________________________________________
(4)乙醇消去反应制乙烯:______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题:
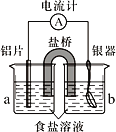
(1)铝为________极,KNO3盐桥中的________离子进入a烧杯中,银器的电极反应式为________。
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极的电极反应式是_________,总反应方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧硫酸氢钾复合盐(K2SO4KHSO42KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
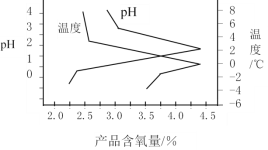
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI
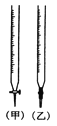
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com