
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:_______________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与 100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为______L,转移的电子数____个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体 _____mol。
(3)将标准状况下 6.72L 的 HCl 溶于水形成 250mL 溶液,取出 10mL 于锥形瓶中,溶质的物质的量浓度为_________mol/L,向锥形瓶中滴加 0.5mol/LBa(OH)2 溶液,恰好反应,消耗Ba(OH)2 的体积为______mL。
【答案】2NaCl + 2H2O ![]() 2NaOH + H2 ↑+ Cl2↑ 5.6 0.5NA 0.7 1.2 12
2NaOH + H2 ↑+ Cl2↑ 5.6 0.5NA 0.7 1.2 12
【解析】
(1)电解饱和食盐水生成NaOH、Cl2和H2;
(2)根据n=![]() 计算KMnO4的物质的量,根据方程式计算生成氯气的物质的量,再计算氯气的体积和转移的电子的物质的量;根据氯原子守恒计算反应后溶液中n(Cl-),根据氯离子守恒可知n(AgCl)=n(Cl-);
计算KMnO4的物质的量,根据方程式计算生成氯气的物质的量,再计算氯气的体积和转移的电子的物质的量;根据氯原子守恒计算反应后溶液中n(Cl-),根据氯离子守恒可知n(AgCl)=n(Cl-);
(3)标准状况下 6.72L 的 HCl的物质的量为![]() =0.3mol,根据c=
=0.3mol,根据c=![]() 计算溶液的物质量浓度,再结合溶液是均一的及中和反应的实质计算滴定时消耗Ba(OH)2 的体积。
计算溶液的物质量浓度,再结合溶液是均一的及中和反应的实质计算滴定时消耗Ba(OH)2 的体积。
(1)电解饱和食盐水生成NaOH、Cl2和H2,发生反应的化学方程式为2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑;
2NaOH + H2↑+ Cl2↑;
(2)15.8g高锰酸钾的物质的量为:![]() =0.1mol,浓盐酸的物质的量为0.1L×12mol/L=1.2mol,则:
=0.1mol,浓盐酸的物质的量为0.1L×12mol/L=1.2mol,则:
2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O
2mol16mol 5mol
0.1mol 0.8mol0.25mol
这说明反应中浓盐酸是过量的,因此生成的氯气在标准状况下的体积为0.25mol×22.4L/mol=5.6L;
反应中Cl元素化合价从-1价升高为0价,则反应中转移电子的数目为0.25mol×2×NA=0.5NA;
根据氯原子守恒可知,溶液中氯离子的物质的量=1.2mol-0.5mol=0.7mol,则根据氯原子守恒可知生成的氯化银的物质的量是0.7mol;
(3)标准状况下 6.72L 的 HCl的物质的量为![]() =0.3mol,则溶液的物质量浓度c=
=0.3mol,则溶液的物质量浓度c=![]() =
=![]() =1.2mol/L,溶液是均一、稳定的混合物,取出10mL的盐酸溶液的物质的量浓度仍为1.2mol/L;锥形瓶中滴加 0.5mol/LBa(OH)2 溶液,恰好反应时,设消耗Ba(OH)2 的体积VmL,则1.2mol/L×10×10-3L=0.5mol/L×2×V×10-3L,解得:V=12mL。
=1.2mol/L,溶液是均一、稳定的混合物,取出10mL的盐酸溶液的物质的量浓度仍为1.2mol/L;锥形瓶中滴加 0.5mol/LBa(OH)2 溶液,恰好反应时,设消耗Ba(OH)2 的体积VmL,则1.2mol/L×10×10-3L=0.5mol/L×2×V×10-3L,解得:V=12mL。


科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
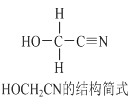
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
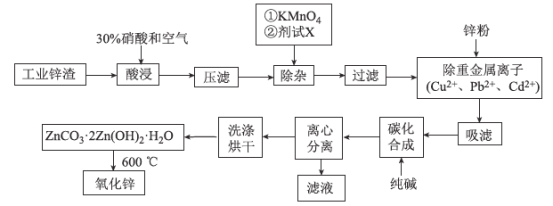
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
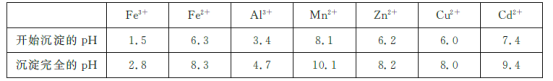
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃 A(标准状况下密度为 1.25g/L)能发生如下转化,反应①中水分子所含氧原子用 18O 标记,D 具有酸性,能使溴水褪色,相对分子质量为 72,且 D 中不含18O,E 具有水果香味,F 为高分子化合物。

(1)烃 A 的电子式为_________;有机物 B 所含官能团名称为_________; 有机物 D 的含氧官能团的结构简式为_____;反应③的另一产物水中_____(填“是”或“否”)含有 18O;E 的结构简式为_________;
(2)写出比烃 A 多一个碳原子的 A 的同系物发生加聚反应的化学方程式:_____;
(3)写出反应②的化学方程式:_____;
(4)写出反应④的化学方程式:_____;
(5)写出 B 与第三周期第ⅠA 族元素的单质反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH相同、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
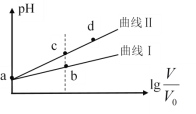
A.曲线Ⅰ代表CH3COOH溶液
B.溶液中水的电离程度:b点小于c点
C.相同体积a点的两种酸分别与NaOH溶液恰好中和后,溶液中n(NO2-)>n(CH3COO-)
D.由c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com