
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
科目:高中化学 来源: 题型:
【题目】利用如图装置模拟铁的电化学保护。下列说法正确的是
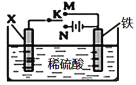
A.若X为锌棒,开关K置于M处,为外加电流阴极保护法
B.若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法
C.若X为锌棒,开关K置于M处,Zn极发生:Zn-2e→Zn2+
D.若X为碳棒,开关K置于N处,X极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
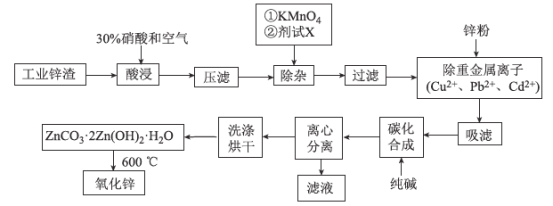
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
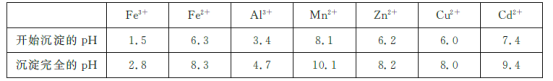
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A 是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

(1)A 的化学式为_____。
(2)已知化合物 A 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为 1.518 g·L-1)。该气体分子的电子式为_____,写出该反应的离子方程式:_____。
(3)写出 F→G 反应的化学方程式:_____。
(4)设计实验方案探究溶液 G 中的主要微粒(不考虑 H2O、H+、K+、I-):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃 A(标准状况下密度为 1.25g/L)能发生如下转化,反应①中水分子所含氧原子用 18O 标记,D 具有酸性,能使溴水褪色,相对分子质量为 72,且 D 中不含18O,E 具有水果香味,F 为高分子化合物。

(1)烃 A 的电子式为_________;有机物 B 所含官能团名称为_________; 有机物 D 的含氧官能团的结构简式为_____;反应③的另一产物水中_____(填“是”或“否”)含有 18O;E 的结构简式为_________;
(2)写出比烃 A 多一个碳原子的 A 的同系物发生加聚反应的化学方程式:_____;
(3)写出反应②的化学方程式:_____;
(4)写出反应④的化学方程式:_____;
(5)写出 B 与第三周期第ⅠA 族元素的单质反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
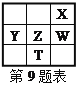
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com