
【题目】磁性材料A 是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

(1)A 的化学式为_____。
(2)已知化合物 A 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为 1.518 g·L-1)。该气体分子的电子式为_____,写出该反应的离子方程式:_____。
(3)写出 F→G 反应的化学方程式:_____。
(4)设计实验方案探究溶液 G 中的主要微粒(不考虑 H2O、H+、K+、I-):_____。
【答案】Fe3S4 ![]() Fe3S4+6H+=3Fe2++S+3H2S↑ H2SO3+I2+H2O=H2SO4+2HI 取溶液 G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若又产生白色沉淀,则有 H2SO3。
Fe3S4+6H+=3Fe2++S+3H2S↑ H2SO3+I2+H2O=H2SO4+2HI 取溶液 G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若又产生白色沉淀,则有 H2SO3。
【解析】
C溶液显黄色,加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,B为红棕色固体,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015 mol,n(Fe)=2n(Fe2O3)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,A燃烧生成的无色气体E溶于水得到酸性溶液,加入碘的KI溶液,得到无色溶液G且溶液酸性变强,说明碘单质可氧化E的水溶液,E应为SO2,F为H2SO3,G中含有H2SO4和HI,可能含有未反应的H2SO3,根据原子守恒可知A含有Fe、S元素,且m(S)=2.960 g-1.68 g=1.28 g,n(S)=
=0.015 mol,n(Fe)=2n(Fe2O3)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,A燃烧生成的无色气体E溶于水得到酸性溶液,加入碘的KI溶液,得到无色溶液G且溶液酸性变强,说明碘单质可氧化E的水溶液,E应为SO2,F为H2SO3,G中含有H2SO4和HI,可能含有未反应的H2SO3,根据原子守恒可知A含有Fe、S元素,且m(S)=2.960 g-1.68 g=1.28 g,n(S)=![]() =0.04 mol,可知n(Fe):n(S)=3:4,A的化学式为Fe3S4,以此解答该题。
=0.04 mol,可知n(Fe):n(S)=3:4,A的化学式为Fe3S4,以此解答该题。
根据上述分析可知:A是Fe3S4,B是Fe2O3,C是FeCl3,D为Fe(SCN)3,E是SO2,F为H2SO3,G中含H2SO4、HI及H2SO3等。
(1)由以上分析可知,A组成元素为Fe、S,化学式为Fe3S4;
(2)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 gL-1),淡黄色不溶物为S,气体的摩尔质量为1.518 g/L×22.4 L/mol=34 g/mol,则气体相对分子质量是34,该气体为H2S气体,H2S分子中S原子最外层有6个电子,其中的2个成单电子与2个H原子的电子形成2对共用电子对,使分子中每个原子都达到稳定结构,故H2S电子式为![]() ,该反应的离子方程式为:Fe3S4+6H+=3Fe2++S+3H2S↑;
,该反应的离子方程式为:Fe3S4+6H+=3Fe2++S+3H2S↑;
(3)F为H2SO3,该物质具有还原性,在溶液中被I2氧化成H2SO4,I2被还原成HI,所以F→G反应的化学方程式为H2SO3+I2+H2O=H2SO4+2HI;
(4)溶液G中的主要微粒(不考虑H2O,H+,K+,I-)为SO42-和H2SO3,可先检验SO42-,后检验有H2SO3,利用BaSO4既不溶于水,也不溶于酸的性质检验,具体操作为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;利用H2SO3的还原性进行检验,过滤后取滤液,向其中滴加H2O2溶液,若又产生白色沉淀,证明含有H2SO3。


科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是
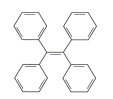
A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) ![]() KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__;NaAlSi3O8改写成氧化物形式是___。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
分析数据可以得出,氯化钠熔浸钾长石是__________反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______。
(5)Na(l)+KCl(l) ![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
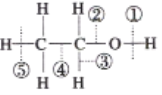
A. 和金属钠反应时键①断裂,发生置换反应
B. 在铜催化下与O2共热反应时断裂①和③,发生氧化反应
C. 与浓硫酸共热170°C下,主要断裂①和②,发生取代反应
D. 在空气中完全燃烧时断裂①②③④⑤,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: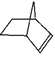
(1)降冰片烯属于__________。
A.环烃 B.烷烃 C.不饱和烃 D.芳香烃
(2)降冰片烯的分子式为____________.
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为________.
(4)推断降冰片烯应该具有的性质是__________。
A.能溶于水 B.能使高锰酸钾溶液褪色
C.能与氢气发生加成反应 D.常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子、10个中子的原子的符号__________。
(2)画出Si原子的原子结构示意图 ________________________。
(3)写出H2O的电子式 ________
(4)第34号元素在元素周期表中的位置____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验 SO![]() 离子的存在时,先在待测溶液中加入盐酸,其作用是( )
离子的存在时,先在待测溶液中加入盐酸,其作用是( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除 SO![]() 以外的其它阴离子及 Ag+的干扰
以外的其它阴离子及 Ag+的干扰
D.排除 Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用下图所示装置快速制取氨并验证氨的某些性质,同时收集少量纯净的氮气,请回答。
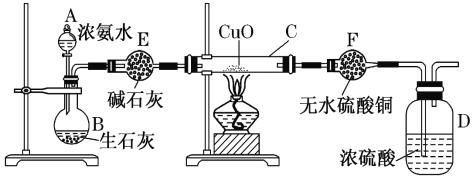
(1)写出用生石灰和浓氨水反应制氨的化学方程式____________________________,解释放出NH3的原因_______________________________________________________。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:___________________________________,
(3)在最后的出气导管口处收集干燥、纯净的氮气,收集方法是________。
A.排空气法 B.排水法 C.用气囊收集
(4) E中的碱石灰________(填“能”或“不能”)换成CaCl2。
(5) 在浓硝酸中放入铜片,若铜有剩余,开始反应的化学方程式为 __________________,
(6) 若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生NO和NO2 气体V L(标准状况),将产生的气体与一定量的氧气混合恰好被一定量的NaOH溶液吸收生成硝酸盐,则通入氧气的物质的量是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com