
【题目】银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题:
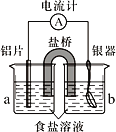
(1)铝为________极,KNO3盐桥中的________离子进入a烧杯中,银器的电极反应式为________。
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极的电极反应式是_________,总反应方程式_______
【答案】负 ![]() Ag2S+2e-=2Ag+S2- Al-3e-=Al3+ 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
Ag2S+2e-=2Ag+S2- Al-3e-=Al3+ 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
【解析】
铝片、表面变黑的银质器皿、食盐溶液构成原电池,由于铝的金属活动性比银强,所以铝片作负极,银器皿作正极。在负极,铝失电子生成铝离子,为中和电性,盐桥中的阴离子进入负极区溶液中;在正极,银表面的硫化银得电子生成银和硫离子,为中和电性,盐桥中的阳离子进入正极区溶液中。原电池反应发生后,若将两溶液混合,则负极生成的铝离子与正极生成的硫离子会发生双水解反应。
(1)因为铝的金属活动性比银强,所以铝为负极,电极反应为Al-3e-=Al3+,为中和电性,KNO3盐桥中的![]() 离子进入a烧杯中,银器表面Ag2S得电子,生成Ag和S2-,电极反应式为Ag2S+2e-=2Ag+S2-。答案为:负;
离子进入a烧杯中,银器表面Ag2S得电子,生成Ag和S2-,电极反应式为Ag2S+2e-=2Ag+S2-。答案为:负;![]() ;Ag2S+2e-=2Ag+S2-;
;Ag2S+2e-=2Ag+S2-;
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极为Al失电子生成Al3+,电极反应式是Al-3e-=Al3+,正极为Ag2S+2e-=2Ag+S2-,两电极产生的离子能发生双水解反应,生成H2S和Al(OH)3,总反应方程式为3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓。答案为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓。


科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
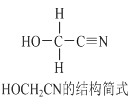
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
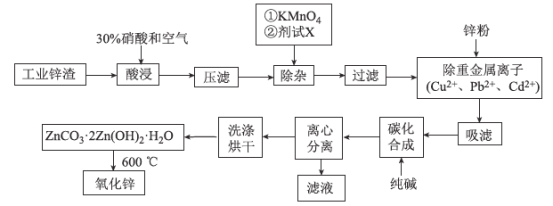
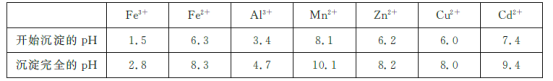
已知:相关金属离子[c(Mn+)=0.1 mol/L]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5 mol/L左右。写出一种加快锌渣浸出的方法:_____________________________________
(2)为调节溶液的pH,则试剂X为________(填化学式),且调节溶液pH的范围是________。
(3)除杂时加入高锰酸钾的作用是___________,发生反应的离子方程式为_______________。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:_________________________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃 A(标准状况下密度为 1.25g/L)能发生如下转化,反应①中水分子所含氧原子用 18O 标记,D 具有酸性,能使溴水褪色,相对分子质量为 72,且 D 中不含18O,E 具有水果香味,F 为高分子化合物。

(1)烃 A 的电子式为_________;有机物 B 所含官能团名称为_________; 有机物 D 的含氧官能团的结构简式为_____;反应③的另一产物水中_____(填“是”或“否”)含有 18O;E 的结构简式为_________;
(2)写出比烃 A 多一个碳原子的 A 的同系物发生加聚反应的化学方程式:_____;
(3)写出反应②的化学方程式:_____;
(4)写出反应④的化学方程式:_____;
(5)写出 B 与第三周期第ⅠA 族元素的单质反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列6种符号回答问题:①1H ②2H ③3H ④14C ⑤14N ⑥16O
(1)共有________种核素,属于________种元素。
(2)互为同位素的是___________。(填序号,下同)
(3)中子数相等的是________________。
Ⅱ.有下列物质:①CO2 ②KCl ③氮气 ④H2⑤NH4Cl ⑥NaOH ⑦H2SO4试用以上编号填空:
(1)只有非极性键的是______________;
(2)只有极性键的是__________________;
(3)只有离子键的是___________________;
(4)既有离子键,又有极性键的是___________________;
(5)属于共价化合物的是___________________。
Ⅲ.写出下列物质的电子式
(1)N2__________;HClO_________;MgCl2___________;NaOH___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行如下实验,能达到实验目的的是( )
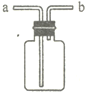
A.瓶中盛满水,从b口进气,用排水法收集NO2
B.瓶中盛适量浓硫酸,从a口进气干燥NH3
C.从b口进气,用排空气法收集CO2
D.瓶中装满水,a口连接导管并伸入量筒中,从b口进气,测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH相同、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
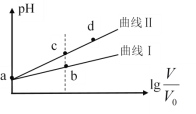
A.曲线Ⅰ代表CH3COOH溶液
B.溶液中水的电离程度:b点小于c点
C.相同体积a点的两种酸分别与NaOH溶液恰好中和后,溶液中n(NO2-)>n(CH3COO-)
D.由c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是 ( )
A. 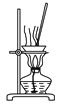 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 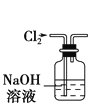 用图所示装置除去Cl2中含有的少量HCl
用图所示装置除去Cl2中含有的少量HCl
C. 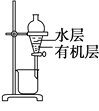 用图所示装置分离CCl4萃取碘水后已分层的有机层和水层
用图所示装置分离CCl4萃取碘水后已分层的有机层和水层
D. 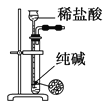 用图所示装置制取少量纯净的CO2气体
用图所示装置制取少量纯净的CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com