
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是

A.b电极发生还原反应:4H++O2+4e-=2H2O
B.电路中有4mol电子发生转移,大约消耗标准状况下22.4L空气
C.维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子
D.HS-在硫氧化菌作用下转化为![]() 的反应是
的反应是![]() =
=![]()
【答案】B
【解析】
A.燃料电池通氧气的极为正极,则b电极为正极,发生还原反应,电极反应为4H++O2+4e-=2H2O,故A正确;
B.电路中有4mol电子发生转移,消耗氧气的物质的量为![]() =1mol,标准状况下体积为22.4L,则大约消耗标准状况下空气22.4L×5=112L,故B错误;
=1mol,标准状况下体积为22.4L,则大约消耗标准状况下空气22.4L×5=112L,故B错误;
C.硫酸盐还原菌可以将有机物氧化成二氧化碳,而硫氧化菌可以将硫氢根离子氧化成硫酸根离子,则两种细菌存在,就会循环把有机物氧化成CO2 放出电子,故C正确;
D.负极上HS-在硫氧化菌作用下转化为SO42-,失电子发生氧化反应,电极反应式是HS-+4H2O-8e-=SO42-+9H+,故D正确;
故答案为B。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
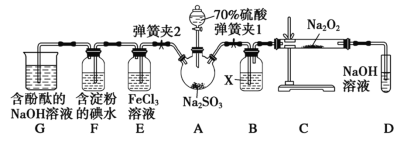
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
(查阅资料)① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O![]() Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式: ____Cu2++ ____SO32-+ ____ =____Cu2O↓+ ____ + ____HSO3-
(实验探究)
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______。
(5)iii中砖红色沉淀消失的原因是_______。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)元素是人体必需的微量元素之一。下列说法正确的是
A.硒的摄入量越多对人体健康越好B.SeO32-空间构型为正四面体
C.H2Se的熔沸点比H2S高D.H2SeO4的酸性比H2SO4强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铝是两种重要的金属。请根据钠与铝的性质回答下列问题:
(1)将一小块金属钠投入水中,可观察到的实验现象是____________;
(2)钠在自然界中最主要的存在形式是__________;
(3)相同质量的钠在下列哪种情况下产生的氢气最多_________;
A.放在水中 B.放在足量盐酸中 C.放在足量CuSO4溶液中 D.用刺有小孔的铝箔包好放入足量水中
(4)铝分别与足量的NaOH溶液和盐酸反应,若两个反应在相同状况下放出等量的气体,则反应中消耗的NaOH和HCl物质的量之比为_________;
(5)常温下铝具有较强的抗腐蚀性,主要原因是__________;
(6)将铝片投入到下列溶液中,铝片不溶解的是______
A.NaOH溶液 B. NaCl溶液 C. H2SO4溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
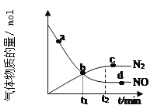
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______(填“吸收”或“放出”)的能量为_______kJ。
(3) 一定条件下,在 5 L密闭容器内,反应 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ molL-1s-1。在第 5s 时,NO2 的转化率为___________。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,22.4L已烷含有的共价键总数为19NA
B.16 g O2和14C2H4的混合物中所含中子数为8NA
C.1 L 0.1 mol·L-1 Na2CO3溶液中阴阳离子数之和为0.3NA
D.密闭容器中1.5 mol H2与0.5 mol N2充分反应,得到NH4的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com