
ЁОЬтФПЁПФГЭЌбЇбаОПХЈЖШЖдЛЏбЇЦНКтЕФгАЯьЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
вбжЊЃКCr2O72-(aq)(ГШЩЋ)+H2O(l) | |
ВНжшЃК ЁЁЁЁЁЁЁЁ | ЯжЯѓЃК Д§ЪдЙмbжабеЩЋВЛБфКѓгыЪдЙмaБШНЯЃЌ ШмвКбеЩЋБфЧГЁЃ ЕЮМгХЈСђЫсЃЌЪдЙмcЮТЖШТдгаЩ§ИпЃЌ ШмвКбеЩЋгыЪдЙмaЯрБШЃЌБфЩюЁЃ |
A. ИУЗДгІЪЧвЛИібѕЛЏЛЙдЗДгІ
B. Д§ЪдЙмbжаШмвКбеЩЋВЛБфЕФФПЕФЪЧЪЙCr2O72-ЭъШЋЗДгІ
C. ИУЪЕбщВЛФмжЄУїМѕаЁЩњГЩЮяХЈЖШЃЌЦНКте§ЯђвЦЖЏ
D. ЪдЙмcжаЕФЯжЯѓЫЕУїгАЯьЦНКтЕФжївЊвђЫиЪЧЮТЖШ
ЁОД№АИЁПC
ЁОНтЮіЁП
ЪдЬтAЃЎЗДгІжадЊЫиЛЏКЯМлУЛгаБфЛЏЃЌВЛЪєгкбѕЛЏЛЙдЗДгІЃЌЙЪAДэЮѓЃЛ
BЃЎЪдЙмbжаШмвКбеЩЋВЛБфЕФФПЕФЪЧЪЙЗДгІЕНДяЦНКтЃЌЧвПЩФцЗДгІжаЗДгІЮяВЛФмЭъШЋзЊЛЏЃЌЙЪBДэЮѓЃЛ
CЃЎМгШыЧтбѕЛЏФЦШмвКЃЌдіДѓЧтбѕИљРызгХЈЖШПЩФмЪЙЦНКте§ЯђвЦЖЏЃЌЕЋВЛФмжЄУївЛЖЈЪЧМѕаЁЩњГЩЮяХЈЖШЪЙЦНКте§ЯђвЦЖЏЃЌЙЪCе§ШЗЃЛ
DЃЎдіДѓЧтРызгХЈЖШЁЂЮТЖШЩ§ИпОљЪЙЦНКтФцЯђвЦЖЏЃЌЮоЗЈЫЕУїгАЯьЦНКтЕФжївЊвђЫиЪЧЮТЖШЃЌЙЪDДэЮѓЁЃ


 дЦФЯЪІДѓИНаЁвЛЯпУћЪІЬсгХзївЕЯЕСаД№АИ
дЦФЯЪІДѓИНаЁвЛЯпУћЪІЬсгХзївЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉХнФУ№Л№ЦїФкзАгаNaHCO3БЅКЭШмвКЃЌИУШмвКГЪМюадЕФдвђЪЧЃК________________ЃЈаДРызгЗНГЬЪНЃЉЃЛУ№Л№ЦїФкСэгавЛШнЦїжазАгаAl2(SO4) 3ШмвКЃЌИУШмвКГЪЫсадЕФдвђЪЧЃК________ЃЈаДРызгЗНГЬЪНЃЉЁЃЕБвтЭтЪЇЛ№ЪБЃЌЪЙХнФУ№Л№ЦїЕЙЙ§РДМДПЩЪЙвЉвКЛьКЯЃЌХчГіCO2КЭAl(OH)3ЃЌзшжЙЛ№ЪЦТћбгЁЃЦфЯрЙиЕФРызгЗНГЬЪНЮЊЃК______________________________ЁЃ
ЃЈ2ЃЉМюадаПУЬИЩЕчГиИКМЋЕФЕчМЋЗДгІЃК_____________________________ЃКМзДМШМСЯЕчГидкМюадЬѕМўЯТИКМЋЕФЕчМЋЗДгІЃК__________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк2008ФъГѕЮвЙњФЯЗНдтгіЕФБљбЉджКІжаЃЌЪЙгУСЫвЛжжШкбЉМСЃЌЦфжївЊГЩЗжЕФЛЏбЇЪНЮЊXY2ЃЌXЁЂYОљЮЊжмЦкБэЧА20КХдЊЫиЃЌЦфбєРызгКЭвѕРызгЕФЕчзгВуНсЙЙЯрЭЌЃЌЧв1molXY2КЌга54molЕчзгЁЃ
(1)ИУШкбЉМСЕФЛЏбЇЪНЪЧ__________ЃКXгыЧтдЊЫиаЮГЩЕФЛЏКЯЮяЕФЕчзгЪНЪЧ__________ЁЃ
(2)дЊЫиDЁЂEдзгЕФзюЭтВуЕчзгЪ§ЪЧЦфЕчзгВуЪ§ЕФ2БЖЃЌDгыYЯрСкЃЌDгыEФмаЮГЩвЛжжШ§КЫЗжзгЃЌИУЗжзгЕФНсЙЙЪНЮЊ__________ЃЛDЫљдкзхдЊЫиЕФЧтЛЏЮяжаЗаЕузюЕЭЕФЪЧ__________ЁЃ
(3)дЊЫиRгыYЭЌжїзхЃЌЦфЧтЛЏЮяФмгУгкПЬЪДВЃСЇЃЌR2гыNaOHШмвКЗДгІЕФВњЮяжЎвЛЪЧOR2ЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк63Li 73Li 2311Na 2412Mg 146C 147Nжа
ЃЈ1ЃЉ_______КЭ_______ЛЅЮЊЭЌЮЛЫи
ЃЈ2ЃЉ_______КЭ_______ЕФжЪСПЪ§ЯрЕШЃЌЕЋВЛФмЛЅГЦЭЌЮЛЫи
ЃЈ3ЃЉ_______КЭ_______ЕФжазгЪ§ЯрЕШЃЌЕЋжЪзгЪ§ВЛЕШЃЌЫљвдВЛЪєгкЭЌжждЊЫи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІmAЃЈsЃЉ+nBЃЈgЃЉeCЃЈgЃЉ+fDЃЈgЃЉЃЌЗДгІЙ§ГЬжаЃЌ ЕБЦфЫќЬѕМўВЛБфЪБЃЌCЕФАйЗжКЌСПЃЈC%ЃЉгыЮТЖШЃЈTЃЉКЭбЙЧПЃЈPЃЉЕФЙиЯЕШчЭМЃЌЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎДяЕНЦНКтКѓЃЌМгШыДпЛЏМСдђC%діДѓ
BЃЎДяЕНЦНКтКѓЃЌШєЩ§ЮТЃЌЦНКтзѓвЦ
CЃЎЛЏбЇЗНГЬЪНжаnЃМe+f
DЃЎДяЕНЦНКтКѓЃЌдіМгAЕФСПгаРћгкЦНКтЯђгввЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЬЧРрЁЂгЭжЌЁЂЕААзжЪЕФЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.ЖМжЛгЩCЁЂHЁЂOШ§жждЊЫизщГЩB.ЖМФмЗЂЩњвјОЕЗДгІ
C.ЖМФмЗЂЩњЫЎНтЗДгІD.ЖМЪЧЪГЮяжаЕФЛљБОгЊбјЮяжЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдкШ§ИіЬхЛ§ОљЮЊ0.5LЕФКуШнУмБеШнЦїжаЗЂЩњЗДгІЃКCO(g)+Cl2(g)![]() COCl2(g)ЦфжаШнЦїЂёжа5minЪБЕНДяЦНКтЁЃ
COCl2(g)ЦфжаШнЦїЂёжа5minЪБЕНДяЦНКтЁЃ
ШнЦїБрКХ | ЮТЖШ/Ёц | Ц№ЪМЮяжЪЕФСП/mol | ЦНКтЮяжЪЕФСП/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ђё | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ђђ | 500 | 1.0 | a | 0 | 0.5 |
Ђѓ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ШнЦїЂёжаЧА5minЕФжаЗДгІЫйТЪv(CO)=0.16molЁЄL-1ЁЄmin-1
B. ИУЗДгІЕФе§ЗДгІЮЊЮќШШЗДгІ
C. ШнЦїЂђжаЦ№ЪМЪБCl2ЕФЮяжЪЕФСПЮЊ0.55mol
D. ШєЦ№ЪМЪБМфШнЦїЂёжаМгШыCO0.8molЁЂCl20.8molЃЌДяЕНЦНКтЪБCOЕФзЊЛЏТЪДѓ80%
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ0.1 molЁЄLЃ1ЕФДзЫсШмвКжаДцдкЕчРыЦНКтЃКCH3COOH![]() CH3COOЃЃЋHЃЋЃЌвЊЪЙШмвКжаc(HЃЋ)/c(CH3COOH)жЕдіДѓЃЌПЩвдВЩШЁЕФДыЪЉЪЧ
CH3COOЃЃЋHЃЋЃЌвЊЪЙШмвКжаc(HЃЋ)/c(CH3COOH)жЕдіДѓЃЌПЩвдВЩШЁЕФДыЪЉЪЧ
A. МгЩйСПЩеМю B. Щ§ИпЮТЖШ
C. МгЩйСПБљДзЫс D. МгCH3COONaЙЬЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщЭЌбЇРћгУЯТЭМЫљЪОзАжУ(МаГжМАМгШШзАжУвбТдШЅЃЌзАжУЦјУмадСМКУ)ЬНОПSO2ЕФаджЪ(ЪЕбщЧАвбЪТЯШГ§ШЅзАжУжаЕФПеЦј)ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
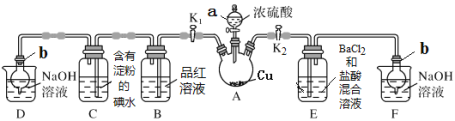
[ВщдФзЪСЯЕУжЊХЈСђЫсЕФЗаЕуЮЊ338 ЁцЃЌОЦОЋЕЦЛ№бцЕФЮТЖШЮЊ400ЁЋ500 Ёц]
ЃЈ1ЃЉвЧЦїaЕФУћГЦ_________ЁЃ
ЃЈ2ЃЉзАжУDКЭFЕФзїгУЪЧ_________ЁЃ
ЃЈ3ЃЉМгШШЪБЃЌзАжУAжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ЃЈ4ЃЉДђПЊK1ЃЌЙиБеK2ЃЌМгШШзАжУAвЛЖЮЪБМфКѓЃЌBжаЕФЯжЯѓЪЧ_____ЃЌЕБзАжУCжаШмвКгЩРЖЩЋБфЮЊЮоЩЋЃЌгЩДЫЭЦВтЫљЕУЮоЩЋШмвКжаЕФРызгжївЊЪЧHЃЋЁЂIЃ КЭ____ЃЛЮЊСЫНјвЛВНЪЕбщжЄЪЕСЫИУЙ§ГЬжаSO2вбБЛбѕЛЏЃЌИУЪЕбщВйзїМАЯжЯѓЪЧЃК_____ЁЃ
ЃЈ5ЃЉЙиБеK1ЃЌДђПЊK2ЃЌгУОЦОЋЕЦМгШШзАжУAЃЌЙлВьЕНEжаЗЂЩњЕФЯжЯѓЪЧЃКгаАзЩЋГСЕэВњЩњЃЌАзЩЋГСЕэЕФГЩЗжЪЧ_____ЃЌЩњГЩАзЩЋГСЕэЕФдвђПЩФмЪЧ___ЃЈбЁЬюзжФИађКХЃЉЁЃ
aЃЎSO2гыBaCl2ШмвКЗДгІЩњГЩСЫАзЩЋГСЕэ
bЃЎBaCl2ШмвКгыСђЫсеєЦјЗДгІЩњГЩСЫАзЩЋГСЕэ
cЃЎSO2ШмгкЫЎЩњГЩЕФH2SO3БЛзАжУФкЕФO2бѕЛЏЩњГЩH2SO4ЃЌдйгыBaCl2ЗДгІЩњГЩАзЩЋГСЕэ
ЃЈ6ЃЉШЁAжаВњЩњЕФSO2ЦјЬхЭЈШызуСПЫЋбѕЫЎжаЃЌШЛКѓМгШызуСПBaCl2ШмвКЃЌОЙ§ТЫЁЂЯДЕгЁЂИЩдяЕУЕН4.66 gГСЕэЁЃОнДЫЭЦжЊSO2ЦјЬхЕФЬхЛ§ЮЊ___mLЃЈБъзМзДПіЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com