
【题目】下列转化,需要加入氧化剂才能完成的是( )
A. H2SO4 → SO2 B. Fe →FeCl2 C. MnO4-→ Mn2+ D. CO2→CO32-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.干冰升华和液氯气化时要破坏不同的微粒间作用力
B.CO2和SiO2具有相同的化学键类型和晶体类型
C.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
D.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解乙二醛制备乙二酸(HOOC-COOH)的装置如图所示,通电后,Pt2电极上产生的氯气将乙二醛氧化为乙二酸,下列说法正确的是( )
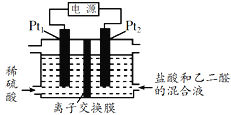
A. Pt2接电源的负极,发生还原反应
B. 电路上每转移1mol电子产生45g乙二酸
C. 盐酸的作用是提供Cl-和增强导电性
D. Pt1极上的电极反应为:2H2O-4e-=== O2↑ + 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H代表燃烧热的是( )
A.CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B.S(s)+3/2O2(g)=SO3(s) △H2
C.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D.2CO(g)+O2(g)=2CO2(g) △H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是:
A. 32gO2和32gO3中所含的原子数都是2NA
B. CH4与P4的分子结构都是正四面体,因此1molCH4或P4分子中含有共价键的数目都为4NA
C. 标准状态下,2.24LCl2溶于水,转移的电子数目为0.1NA
D. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的熔、沸点有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛地存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_______ (用元素符号表示,下同)。
(2)写出W的价电子排布式________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_______。
(3)根据等电子体原理,可知化合物XZ的结构式是______,YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________(用化学式表示),原因是____________________。
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_______,该物质硬度大,推测该物质为______晶体。其中Y元素的杂化方式是____________。
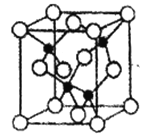
(6)U的晶体属立方晶系,其晶胞边长为405Pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型________________(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料,胶合板、内墙涂料会释放出一种刺激性气味的气体,该气体是( )
A.甲烷B.甲醛C.氨气D.二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com