
X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是金属元素。其相关信息如下表:
元素 | 相关信息 |
X | X一种核素在考古时常用来坚定一些文物的年代 |
Y | Y基态原子的s轨道电子与P轨道电子数相等 |
Z | Z是所在周期的单核离子中半径最小 |
W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
T | T有多种化合物,其白色氢氧化物在空气中会迅速变为灰绿色,最后变为红褐色 |
(1)X、Y、Z三种元素的电负性由大到小的顺序是________(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是??? ????????????? 。
(2)T2+的电子排布式为_________;T的单质在高温下与Y的氢化物反应,其化学方程式为??????????????? ;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为 ?? ?????????????????????????
(3)两种氢化物X2H2和H2Y2沸点相差很大,其沸点较高的是_______________,两者沸点相差很大的原因是____________________________________。
(4)在25℃、101 kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式为 _____________。
(1)O>C>Al??? H—O
(2)[Ar]3d6??? 3Fe+4H2O(g) 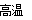 Fe3O4+4H2? ?? SiO2 + 2C
Fe3O4+4H2? ?? SiO2 + 2C  Si + 2CO↑
Si + 2CO↑
(3)H2O2?? H2O2分子间存在氢键
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.?
【解析】
试题分析:(1)根据题目提供的信息可推知:X是C;Y是O;Z是Al;W是Si;T是Fe。元素的原子半径越小,元素的非金属性越强,其电负性就越大。在Al、C、O三种元素中非金属性强弱顺序为O>C>Al。所以电负性O>C>Al。元素的非金属性越强,其与H形成的共价键的极性就越强。因此在C—H和H—O键中极性强的是H—O。(2)26号元素Fe失去2个电子后此外层变为最外层。电子排布式为1s22s22p63s23p63d6.或写为[Ar]3d6。高温下Fe与水蒸气反应的方程式为3Fe+4H2O(g) 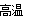 Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C
Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C 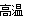 Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2 比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。?
Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2 比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。?
考点:考查元素的推断、共价键、电负性的比较、原子的电子排布式的书写、化学方程式、热化学方程式的书写的知识。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:

A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
| |||||||||||||||||||||||||||
| B、图甲表示Zn-Cu原电池反应过程中的电流强度的变化.T时可能加入了H2O2 | |||||||||||||||||||||||||||
| C、图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 | |||||||||||||||||||||||||||
| D、图丙表示元素周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃河西五市高三第一次联合考试化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素 。其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物; Z原子最外层电子数是次外层电子数的3倍,W与X同主族,W与T形成的化合物WT是厨房必需的调味品。下列说法正确的是(?? )
A.原子半径: T> W > Z > Y
B.W与T的单质可通过电解饱和的WT水溶液获得
C.Z与W形成的两种化合物中化学键类型完全相同
D.元素X、Z与T可形成多种酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市六校高三第三次联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号 | 相关信息 |
X | 它的一种核素的原子核内没有中子 |
Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
Z | 基态原子的最外层电子排布式为nsnnpn+1 |
W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)??? ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
|
元素代号 |
相关信息 |
|
X |
它的一种核素的原子核内没有中子 |
|
Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
|
Z |
基态原子的最外层电子排布式为nsnnpn+1 |
|
W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
|
T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:
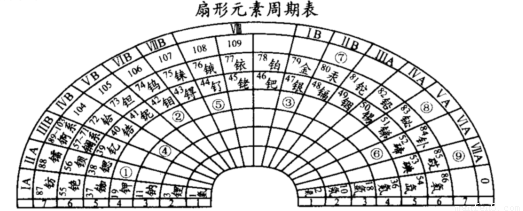
T元素在扇形元素周期表中的位置是 (填表中带圆圈的数字);上表中⑨号位置 的元素基态原子未成对电子数为 ;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是 (填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为 ,在这五种元素中电负性最大的是 。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为 。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式: 。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com