
【题目】同分异构现象是造成有机物种类繁多的重要原因之一。下列各组物质互为同分异构体的是
A. 甲烷与丙烷 B. CH2=CH2与CH3CH3
C. 纤维素与淀粉 D. CH3CH2OH与CH3OCH3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
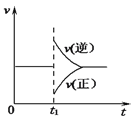
A. 维持温度、反应体系体积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度不变,t1时扩大反应体系体积
D. 维持温度、容器体积不变,t1时充入SO3(g),同时减少SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
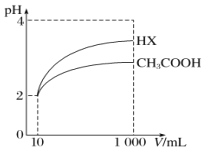
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是
CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是

A. M点的正反应速率v正大于N点的逆反应速率v逆
B. 若投料比n(H2) :n(CO2) =4:1,则图中M点己烯的体积分数为5.88%
C. 250℃,催化剂对CO2平衡转化率的影响最大
D. 当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废弃物的回收处理可以从源头上减少环境污染,不符合该理念的是
A. 废旧书刊焚烧处理 B. 废旧铅蓄电池回收金属铅
C. 将垃圾分类并回收处理 D. 废旧汽车回收钢铁和塑料等材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )
A.KCl
B.KCl和I2
C.KCl和Br2
D.KCl和KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )

A. 前10 min内,用v(NO2)表示的反应速率为0.04 mol·L-1·min-1
B. 反应进行到10 min时,体系放出的热量为9.68 kJ
C. a点正反应速率小于逆反应速率
D. 25 min时,正反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com