
����Ŀ������ѧѡ��3:���ʽṹ�����ʡ�A��B��C��D��E����Ԫ�ص�ԭ�����������������зǽ���Ԫ��A�Ļ�̬ԭ���гɶԵ�������δ��ʱ��������������CԪ���ڵؿ��к�����ߣ�D�ĵ����Ƕ��������۵���͵Ľ�����E�ĺϽ����ҹ�ʹ������ĺϽ�
��1��EԪ�صĻ�̬ԭ�ӵ����Ų�ʽΪ__________________��
��2��A��ij���⻯��A2H2�����к���___���Ҽ���____���м���
��3��A �ĺ����������AO3n-�Ŀռ乹����___________��
��4��B������⻯��ķе��A ������⻯��ķе�ߵö࣬��ԭ����_____��
��5��E������������Ӧ��ˮ�����ܽ��ڰ�ˮ�����ɵĸ��ӻ�����Ļ�ѧʽ��______��
��6����ͼ��D���ʵľ���ѻ���ʽ�����ֶѻ���ʽ�ľ�����ԭ�ӵ���λ��Ϊ____������ԭ�ӵİ뾶Ϊrpm ���˾�����ܶȦ�=______g/cm3���ú�r�Ĵ���ʽ��ʾ������٤��������NA��ʾ����

���𰸡� 1s22s22p63s23p63d104s1 3 2 �������� �����Ӽ�����γ������������Ӽ䲻�ܣ������ķе�ȼ���� [Cu(NH3)4](OH)2 8 ![]()
�����������������A��B��C��D��E����Ԫ�ص�ԭ��������������CԪ���ڵؿ��к�����ߣ�C����Ԫ�ء����зǽ���Ԫ��A�Ļ�̬ԭ���гɶԵ�������δ��ʱ��������������ԭ������С����Ԫ�أ���A��̼Ԫ�أ�����B�ǵ�Ԫ�ء�D�ĵ����Ƕ��������۵���͵Ľ�������D���ơ�E�ĺϽ����ҹ�ʹ������ĺϽ���E��ͭ���ݴ˷������
������A��B��C��D��E����Ԫ�ص�ԭ��������������CԪ���ڵؿ��к�����ߣ�C����Ԫ�ء����зǽ���Ԫ��A�Ļ�̬ԭ���гɶԵ�������δ��ʱ��������������ԭ������С����Ԫ�أ���A��̼Ԫ�أ�����B�ǵ�Ԫ�ء�D�ĵ����Ƕ��������۵���͵Ľ�������D���ơ�E�ĺϽ����ҹ�ʹ������ĺϽ���E��ͭ��
��1��ͭ��ԭ��������29��ͭԪ�صĻ�̬ԭ�ӵ����Ų�ʽΪ1s22s22p63s23p63d104s1��
��2��A��ij���⻯��A2H2��������Ȳ����Ȳ�ĽṹʽΪH��C��C��H��������к���3��������2��������
��3��A �ĺ����������CO32-��̼ԭ�ӵļ۲���Ӷ�����![]() ������̼����Ŀռ乹����ƽ���������Ρ�
������̼����Ŀռ乹����ƽ���������Ρ�
��4�������Ӽ�����γ������������Ӽ䲻�ܣ������ķе�ȼ������
��5��ͭ������������Ӧ��ˮ����������ͭ�ܽ��ڰ�ˮ�����ɵĸ��ӻ�����Ļ�ѧʽ��[Cu(NH3)4](OH)2��
��6�����ݼصľ����ṹ��֪���ֶѻ���ʽ�ľ�����ԭ�ӵ���λ��Ϊ8������ԭ�ӵİ뾶Ϊrpm�������ĵĶԽ�����4rpm�����Ծ����ı߳���![]() ���þ����������
���þ����������![]() �������к���2����ԭ�ӣ���˾�����ܶ�����
�������к���2����ԭ�ӣ���˾�����ܶ�����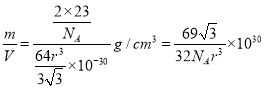 g/cm3��
g/cm3��


 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��T���ֶ�����Ԫ�ء�X��Y��Z��Ԫ�������ڱ��е�λ����ͼ��ʾ����Ԫ�ص�ԭ������֮����41��X��T�ĵ����ڲ�ͬ�����·�Ӧ����������T2X(��ɫ����)��T2X2(����ɫ����)���������ֻ����
X | |
Y | Z |
(1)��Ԫ�صķ�����X______��Y________��Z________��T___________��
(2)Yԭ�ӵĽṹʾ��ͼΪ______________________________________________��
(3)�õ���ʽ��ʾY��T��ɵĻ�������γɹ��̣�_____________________��
(4)X��Y���⻯����ȶ���_________���û�ѧʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һ�°��������ͬ���¶���NaHCO3�ܽ�ȱ�NaCl��Na2CO3��NH4HCO3��NH4Cl���ܽ�ȶ�С�����ʣ�����CO2+NH3+H2O+NaCl��NaHCO3��+NH4Cl�ķ�Ӧԭ���Ʊ������������ʵ���ҽ���ģ��ʵ�����������ʾ��ͼ��
![]()
��������������ȷ����
A. A������CO2��B������NH3
B. �ڢõ��ľ����Ƿ��ͷ۵���Ҫ�ɷ�
C. �ڢ����õ�����Ҫ�����������ձ���©����������
D. �ڢ�����������Ҫ�������ܽ⡢�������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���е�NO��NO2����������γɹ⻯ѧ�������ƻ�������ȡ���������������Һ�Ժ���������ķ������д�������Ӧ�Ļ�ѧ����ʽ���£�
NO2+NO+2NaOH=2 NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
����Ҳ����������������������磬������һ�������ɷ������·�Ӧ�� 4NH3+6NO=5N2+6H2O
��һ����NO��NO2�Ļ������ͨ��300 mL 5mol/LNaOH��Һ�У�ǡ�ñ���ȫ���ա�����˵������ȷ��
A. ԭ���������NO�ڱ�״���µ��������Ϊ16.8 L
B. ������Һ��NaNO3��NaNO2�����ʵ���֮�ȿ���Ϊ1�U2
C. ���ð������������谱���ڱ�״���µ��������Ϊ22.4 L
D. ���ð���������������ʱ�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͭ�����mg����3mol��L-1������Һ100mL��ǡ����ȫ�ܽ⣬��mg�ĸû�����ڹ����������м��ȳ�ַ�Ӧ����ȴ��ʣ���������Ϊ�� ��
A.��m-2.4��g B.(m-1.6) g C.��m-3.2��g D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ļ���������϶࣬��;�㷺��
I������������(Na2S2O5)�dz��õ�ʳƷ��������֮һ�����Ʊ��ķ�Ӧԭ��Ϊ��Na2SO3+ SO2==Na2S2O5
ij�о�С��������ͼװ����ȡNa2S2O5��ʢ����������з�Һ©����

��1��д��װ�ü��з�����Ӧ�Ļ�ѧ����ʽ__________________��
��2���ر�K3��Ҫ��ֻ���װ�ü������ԣ�������д�����ֲ�ͬ�IJ���������
����1��_________________________��
����2��_________________________��
����3��_________________________��
��3��װ���ҵ�������________________��
��4��д�����������ƾ����ڿ����б���ȫ�����Ļ�ѧ����ʽ_____________��
II�������ת������Դ���úͻ�����������Ҫ�о����⡣��H2S�Ϳ����Ļ������ͨ��FeCl3 ��FeCl2��CuCl2�Ļ����Һ�з�Ӧ���Ի���S��������ת����ͼ��ʾ��

��1����Ӧ�е���34gH2Sת��Ϊ����ʱ��������Һ��Fe3���������䣬��Ҫ����O2������Ϊ _____________��
��2�����¶�һ���Ͳ�������Һ�������£�����ͨ�������壬����ֽ��衣��ʹ���ɵ������в���CuS���ɲ�ȡ�Ĵ�ʩ��___________________��
��3��д��ͼ�и���ת���Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.����������̼���ƶ��dz�����θ���кͼ�
B.���������⡢������ƫ������ѪҺƫ����
C.����еĵ����л�ԭ�Զ���ɱ����������
D.���Ρ���ǿ�����͵�Ӫ��ǿ�����ʺ�������ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g)![]() M(g)��N(g)
M(g)��N(g)
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.40 | 0.10 | 0.090 |
�� | 800 | 0.10 | 0.40 | 0.080 |
�� | 800 | 0.20 | 0.20 | a |
�� | 800 | 0.10 | 0.10 | b |
����˵����ȷ���ǡ�(����)
A. ʵ����У���5minʱ���n(M)��0.050mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ���ʦ�(N)��1.0��10��2mol/(L��min)
B. ʵ����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ50%
D. ʵ����У��ﵽƽ��ʱ��b<0.05
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ��ǣ�������
A.Fe3+��Fe2+
B.HCl��Cl2
C.Fe��Fe2+
D.C��CO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com