
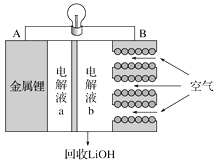
【题目】锂空气电池放电时的工作原理如下图所示。下列叙述正确的是( )
A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2===4LiOH
C. B电极反应式为O2+4e-===2O2-
D. 电解液a可以为氯化锂溶液
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1molL-1的两种一元酸HX和HY溶液,用0.1molL-1的NaOH溶液分别进行滴定,滴定曲线如下图所示。下列有关叙述不正确的是


A. HX的酸性强于HY的酸性,且右图中m<1
B. 当![]() =1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
=1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
C. HY电离程度:b点大于a点
D. 当两溶液均呈中性时,c(X-)= c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水Na2CO3配制250 mL 1.000 mol·L-1 Na2CO3溶液时,下列操作会使配制的溶液浓度偏大的是
A.称量时碳酸钠固体含有结晶水B.溶液未冷却立即定容
C.定容时俯视容量瓶刻度线D.容量瓶没有干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的叙述正确的是( )
A. 蛋白质只能用来调节生命活动 B. 多糖是植物细胞的直接能源物质
C. 晒干的种子因缺乏自由水不能萌发 D. 生物的遗传物质都是 DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯下列物质时选用的试剂或方法不正确的是
分离提纯 | 试剂 | 方法 | |
A | 除去Cl2中的HCl | NaOH溶液 | 洗气 |
B | 提取溴水中的溴单质 | CCl4 | 萃取 |
C | 除去SiO2中的Fe2O3 | 稀盐酸 | 过滤 |
D | 除去乙醇中的水 | 无水CuSO4 | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
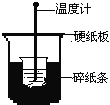
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到60s时体系达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A. 平衡时,N2O4的转化率为60%
B. 平衡时,体系内NO2为0.04mol·L-1
C. 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数增大
D. 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com