
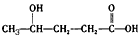 极易失去一分子水而形成环状化合物
极易失去一分子水而形成环状化合物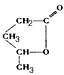 (可简写为
(可简写为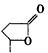 )。现查得一种天然化合物具有抗菌和抗肿瘤的作用,结构简式为
)。现查得一种天然化合物具有抗菌和抗肿瘤的作用,结构简式为 则分子式为________,所含官能团的名称为______________。
则分子式为________,所含官能团的名称为______________。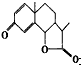 是驱虫药--山道年的结构简式,其含有的官能团名称为___________,该化合物分子中的碳原子数目是________________。
是驱虫药--山道年的结构简式,其含有的官能团名称为___________,该化合物分子中的碳原子数目是________________。  阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为________;
(2)若XeO3是分子晶体,试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
1.已知次溴酸(HBrO)的结构简式为HO—Br,如图乙烯跟溴水中各成分反应既可生成A,同时又可生成B和C2H5Br。

回答下列问题:
(1)环氧乙烷![]() 的结构可简写为
的结构可简写为![]() ,则E的化学式是__________。
,则E的化学式是__________。
(2)A的结构简式是__________;I的结构简式是__________。
(3)写出G转化为H的化学方程式________________________。其反应类型为__________反应。
(4)化合物A—I中,易发生加成反应的物质是__________(填字母)。
2.(一)(1)科技日报
A.Al2H6中H为+1价,Al为-3价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物Al2H6的晶体为分子晶体
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
(二)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
化学式 | A | A | B | D | A2E | DF |
回答下列问题:
(2)化合物丁的电子式为__________。F原子的最外层电子排布式为__________。
(3)化合物戊的沸点比甲__________(填“高”或“低”),写出甲与丁反应的化学方程式:____________________。
(4)
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com