
| A. | ②④⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①④⑤ |
分析 ①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝;
②硫燃烧生成二氧化硫;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得不到无水FeCl3;
④饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠;
⑤氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁.
解答 解:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝,所以Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3,可以实现,故正确;
②硫燃烧生成二氧化硫,得不到三氧化硫,所以S$\stackrel{O_{2}/点燃}{→}$SO3不能实现,故错误;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得到的是氢氧化铁,得不到无水FeCl3,所以FeCl3(aq)$\stackrel{△}{→}$无水FeCl3不能实现,故错误;
④饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠,所以饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 可以实现,故正确;
⑤氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁,所以MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO可以实现,故正确;
故选:D.
点评 本题考查较为综合,侧重于元素化合物知识的综合考查与应用,明确物质的性质是解题关键,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: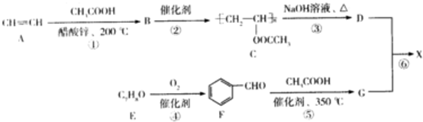

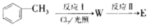
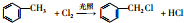 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com