
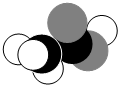
| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 24种 | B. | 16种 | C. | 12种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物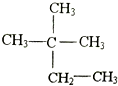 的名称为2-甲基-2-乙基丙烷 的名称为2-甲基-2-乙基丙烷 | |
| B. | 分别向皂化反应完成后的溶液、豆浆、牛奶中加入浓食盐水都有固体析出 | |
| C. | 碳原子数小于5的烷烃共有4种,他们之间互为同系物 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃\CO的体积分数%\投料比 | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在 前50s的平均速率v(PCl5)=0.0032mol.L-1.s-1 | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl5)=0.11mol.L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2反应达到平衡前v正>v逆 | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略).下列说法正确的是( )
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略).下列说法正确的是( )| A. | 若A为非金属单质,则它与Mg反应的产物,其阴阳离子个数比可能为2:3 | |
| B. | 若A为非金属单质,则其组成元素在周期表中的位置肯定处于第二周期第VA族 | |
| C. | 若D的浓溶液在常温下能使铁、铝发生钝化,则A一定为非金属单质 | |
| D. | 若A是共价化含物,0.l mol的A分子中含有的电子数可能为NA (NA为阿佛加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.186 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +1 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应水化物的碱性:Y>R>X | |
| D. | 形成氢化物的沸点:Z>T |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com