
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
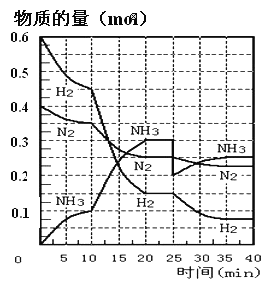
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
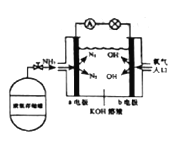
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
【答案】 v(NH3)= 0.005 mol/(L·min) a c e 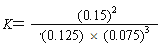 42.86% 移走了生成的氨气(或减小了氨气的浓度) 4NH3(g) + 3O2(g)
42.86% 移走了生成的氨气(或减小了氨气的浓度) 4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于发生4NH3 + 3O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于发生4NH3 + 3O2![]() 2N2 + 6H2O 反应,有水生成,使得溶液逐渐变稀,所以要补充KOH。
2N2 + 6H2O 反应,有水生成,使得溶液逐渐变稀,所以要补充KOH。
【解析】(1)根据反应速率的表达式,c(NH3)=0.1/(2×10)mol/(L·min)=0.005mol/(L·min);(2)由图像可知,各组分物质的量变化增加,,且10min时变化是连续的,20min达到平衡时,N2的物质的量变化量为0.025×4mol=0.1mol,氢气的物质的量变化量为0.025×12mol=0.3mol,NH3物质的量变化量为0.025×8mol=0.2mol,物质的量变化之比等于化学计量时之比,三种气体物质的速率增加倍数相同,说明使用了催化剂,故选项a正确;(3)a、用不同物质反应速率判断达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v正(H2)向正反应方向进行,v逆(NH3)向逆反应方向进行,v正(H2)/v逆(NH3)=3:2,应是2v正(H2)=3v逆(NH3),故错误;b、组分都是气体,气体质量保持不变,又是恒容状态,因此密度不变,不能说明反应达到平衡,故错误;c、反应前后气体系数之和不相等,因此压强不变,说明反应达到平衡,故正确;d、因为不知道开始时投入量是多少,因此分子数之比不能判断是否达到平衡,故错误;e、反应方向一正一逆,且等于反应速率之比,因此达到平衡,故正确;f、反应方向都是向正反应方向进行,因此不能说明达到平衡,故错误;(4)根据平衡常数的定义,表达式为K1=c2(NH3)/[c(N2)×c3(H2)],在20min时第一次达到平衡,n(N2)=0.25mol,n(H2)=0.15mol,n(NH3)=0.3mol,因此有K=(0.3/2)2/[(0.25/2)×(0.15/2)3]或者 ,NH3的体积分数为0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根据图像,第25min时,氨气的量突然减小,而其他物质的量不变,说明此时刻移出NH3或分离出NH3;(6)①N2(g)+3H2(g)
,NH3的体积分数为0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根据图像,第25min时,氨气的量突然减小,而其他物质的量不变,说明此时刻移出NH3或分离出NH3;(6)①N2(g)+3H2(g) ![]() 2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g)
2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根据工作原理,b极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;②总电极反应是4NH3+O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根据工作原理,b极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;②总电极反应是4NH3+O2![]() 2N2+6H2O,KOH的浓度降低,因此需要补充KOH。
2N2+6H2O,KOH的浓度降低,因此需要补充KOH。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法不正确的是
A. 食盐可作调味剂,也可用作食品防腐剂
B. 二氧化硫可用于制作葡萄酒的食品添加剂
C. 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂
D. “地沟油”禁止食用,但可用来制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. Na2O2与H2O反应:2Na2O2+2H2O===4Na++4OH-+O2↑
B. 澄清石灰水中通入少量的CO2:CO2+OH-===HCO![]()
C. Mg(OH)2与盐酸反应:OH-+H+===H2O
D. Zn与AgNO3溶液反应:Zn+Ag+===Zn2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是

A. 盐酸的物质的量浓度为1mol/L
B. 在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)
C. 在点③所示溶液中:由水电离出的c(OH﹣)>10﹣7mol/L
D. 在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V <20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式_________________
(2)反应进行到10min,X的转化率为___________,0~5min内Y的平均反应速率为___________
(3)计算T℃时该反应的平衡常数K=____________
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如下图A、B所示:

10min时改变的反应条件是_______________
②t3时刻改变的反应条件是_______________
③t5时刻改变的反应条件是 ,理由是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015天津)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

① R离子浓度由大到小的顺序是:__________。
② 写出m点反应的离子方程式_________________。
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图一是0.1 molL-1 NH4Al(SO4)2溶液的pH随温度变化的图象。
①其中符合0.1 molL-1 NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 molL-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=_________molL-1(填数值)
(3)室温时,向100 mL 0.1molL-1 NH4HSO4溶液中滴加0.1molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+ 2OH--2e-= ClO-+ H2O
C. 阴极的电极反应式为:2H2O + 2e-= H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO-+ 2H+= N2↑ + 2CO2↑ +5Cl-+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com