
【题目】化学与生产、生活密切相关。下列说法不正确的是
A. 食盐可作调味剂,也可用作食品防腐剂
B. 二氧化硫可用于制作葡萄酒的食品添加剂
C. 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂
D. “地沟油”禁止食用,但可用来制取肥皂
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名烃A:_____________________;

烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物 的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
(3)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:

物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。
(3)结合流程及相关数据分析,步骤V中加入铝粉的目的是________________。
(4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol/L EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。然后将试液调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA完全反应,再调试液pH=4.5,以PAN(1-(2-吡啶偶氨)-2-萘酚)为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00 mL。计算试样中Fe2O3和Al2O3的质量分数。________________(写出计算过程)
(已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)![]() yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
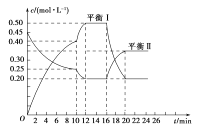
(1)根据图示可确定x∶y=________。
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是____________;第16 min引起曲线变化的反应条件可能是____________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1____________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是
A. c1>c2>c3 B. c1>c3>c2 C. c1=c3>c2 D. c1=c2>c3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为
A.1:10 B.1:1 C.1:2 D.1:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法不正确的是
物质 | 试剂 | 分离方法 | |
A | 淀粉溶液(NaCl) | 水 | 渗析 |
B | CaCO3(CaO) | 水 | 过滤 |
C | KCl溶液(I2) | 酒精 | 萃取 |
D | CO2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
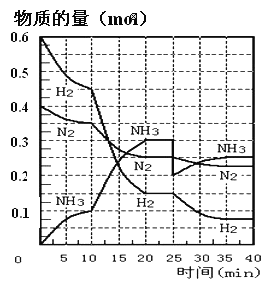
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
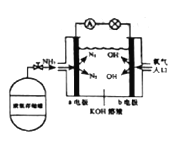
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com